Número Atômico Do Oxigênio – Você já se perguntou qual o segredo por trás desse elemento tão vital para a vida? Prepare-se para uma jornada fascinante pelo universo atômico, onde desvendaremos o número atômico do oxigênio e sua importância na tabela periódica. Descobriremos a sua estrutura, comparando-o com outros elementos e revelando suas propriedades químicas únicas. Vamos mergulhar nas reações que ele protagoniza, e como o oxigênio, em sua essência, molda o mundo ao nosso redor.
O oxigênio, com seu número atômico 8, é um elemento essencial para a vida na Terra. Sua presença na atmosfera, nos oceanos e em todos os organismos vivos faz dele um protagonista fundamental em inúmeros processos. Entender seu número atômico é a chave para compreender suas propriedades e a maneira como interage com outros elementos. Vamos desvendar esses mistérios juntos!
Introdução ao Número Atômico do Oxigênio
O oxigênio, um elemento fundamental para a vida na Terra, desempenha um papel crucial em diversas reações químicas e processos biológicos. Compreender seu número atômico é essencial para desvendar suas propriedades e comportamento. Este texto explora a importância do número atômico do oxigênio, sua relação com a estrutura atômica, a tabela periódica e as propriedades químicas.
Conceito de Número Atômico
O número atômico (Z) de um elemento representa o número de prótons presentes no núcleo de um átomo. É uma propriedade intrínseca que define a identidade do elemento químico. Elementos diferentes possuem diferentes números atômicos, refletindo as diferenças na sua estrutura interna.
Importância do Número Atômico na Identificação dos Elementos
O número atômico é a chave para a distinção de elementos na tabela periódica. Elementos com diferentes números atômicos exibem propriedades químicas e físicas distintas. Por exemplo, o hidrogênio (Z=1) é um gás altamente reativo, enquanto o oxigênio (Z=8) é essencial para a respiração. A diferença nos números atômicos reflete a diferença na estrutura atômica e, consequentemente, nas interações entre os átomos.
Estrutura Atômica do Oxigênio
O átomo de oxigênio possui 8 prótons, 8 elétrons e um número variável de nêutrons, dependendo do isótopo. Os 8 elétrons ocupam diferentes camadas eletrônicas. A configuração eletrônica do oxigênio é 1s 22s 22p 4. Isso significa que o oxigênio tem dois elétrons na camada K (n=1), dois na camada L (n=2), e quatro na camada L (subníveis p).
Essa distribuição eletrônica influencia diretamente as propriedades químicas do elemento.
Comparação com Outros Elementos
Comparando o oxigênio com outros elementos como o hidrogênio (Z=1), carbono (Z=6), nitrogênio (Z=7) e flúor (Z=9), percebe-se que o número atômico do oxigênio é intermediário. Essa posição na tabela periódica reflete suas propriedades químicas, como a tendência a ganhar elétrons e formar ligações. A diferença no número de prótons e elétrons entre esses elementos resulta em comportamentos químicos distintos.
Organização na Tabela Periódica
O oxigênio está localizado no Grupo 16 (ou VIA) e no Período 2 da tabela periódica. Sua posição na tabela reflete a estrutura eletrônica e as propriedades químicas. Elementos do mesmo grupo compartilham semelhanças em suas configurações eletrônicas e, consequentemente, em suas propriedades químicas.
Relação entre Número Atômico e Propriedades Químicas
O número atômico do oxigênio influencia sua reatividade e sua capacidade de formar ligações químicas. O oxigênio, com sua configuração eletrônica, apresenta alta afinidade eletrônica, tendendo a ganhar dois elétrons para atingir a estabilidade de um gás nobre. Essa característica o torna um elemento altamente reativo, capaz de formar ligações covalentes e iônicas com diversos outros elementos. A formação de óxidos é um exemplo clássico da reatividade do oxigênio.
História e Descoberta do Oxigênio
A descoberta do oxigênio, um elemento fundamental para a vida e a combustão, representou um marco crucial na história da química. O processo não foi obra de um único cientista, mas sim o resultado de um esforço coletivo, com contribuições de diversas mentes brilhantes ao longo de décadas. Esta jornada, desde as primeiras especulações até a compreensão moderna, revela a importância da experimentação e da persistência na busca pelo conhecimento científico.A compreensão da composição do ar e dos processos de combustão evoluiu ao longo dos séculos, com diferentes teorias tentando explicar os fenômenos observados.
A ideia do flogístico, uma substância hipotética que seria liberada durante a combustão, foi uma das teorias mais influentes, mas acabou sendo refutada por experimentos e observações mais rigorosas.
Principais Contribuições na Descoberta
Diversos cientistas contribuíram para a compreensão do oxigênio. Suas descobertas, muitas vezes complementares e em alguns casos, até conflitantes, culminaram na descoberta e na compreensão do elemento.
- Antoine Lavoisier: Lavoisier, um químico francês, é amplamente reconhecido como o cientista que consolidou a compreensão do oxigênio como um elemento essencial para a combustão e a respiração. Seus experimentos precisos e bem documentados, como a queima de fósforo em um sistema fechado, permitiram-lhe refutar a teoria do flogístico. Ele demonstrou que o oxigênio era o componente do ar responsável pela combustão e pela respiração, e a importância de sua análise cuidadosa para a construção do conhecimento científico.
- Joseph Priestley: O químico inglês Joseph Priestley, em 1774, descobriu o gás, que ele chamou de “ar deflogisticado”, através do aquecimento de óxido de mercúrio. Embora não tenha compreendido completamente a natureza do gás, suas observações foram cruciais para a descoberta. Sua publicação das observações, em 1774, representou um avanço significativo no conhecimento científico da época.
- Carl Wilhelm Scheele: O químico sueco Carl Wilhelm Scheele, quase simultaneamente a Priestley, também isolou o oxigênio. Seus experimentos com diferentes materiais, como óxido de nitrato de potássio, conduziram à produção do gás. No entanto, suas observações foram publicadas mais tarde que as de Priestley, o que fez com que Priestley fosse frequentemente creditado com a descoberta.
Evolução do Conhecimento Sobre o Oxigênio
A compreensão do oxigênio evoluiu significativamente ao longo do tempo, acompanhando os avanços em outras áreas da ciência. A compreensão de sua composição química e seu papel na química e na fisiologia tornou-se mais precisa e abrangente. Os métodos para a análise da composição do ar, incluindo o isolamento e identificação de gases, foram refinados.
- Composição Química do Ar: A compreensão da composição do ar evoluiu a partir de teorias anteriores, como a teoria do flogístico. Lavoisier, através de seus experimentos, demonstrou que o ar era composto por diferentes gases, incluindo o oxigênio, e que a combustão era um processo de combinação com o oxigênio.
- Papel na Fisiologia: A descoberta do oxigênio teve implicações profundas para a compreensão da respiração. Lavoisier e outros cientistas demonstraram o papel fundamental do oxigênio na respiração dos animais e na produção de energia.
Teorias da Composição do Ar
As teorias sobre a composição do ar antes da descoberta do oxigênio, como a teoria do flogístico, possuíam limitações e contradições. A teoria do flogístico, por exemplo, não conseguia explicar a conservação de massa em reações de combustão.
Determinação do Número Atômico do Oxigênio
A determinação do número atômico do oxigênio, 8, evoluiu com o desenvolvimento de técnicas espectroscópicas e métodos analíticos. O uso da espectroscopia permitiu aos cientistas analisar as propriedades dos átomos e, assim, determinar o número de prótons em seu núcleo.
Propriedades Físicas do Oxigênio
O oxigênio, um elemento fundamental para a vida na Terra, apresenta características físicas únicas que o distinguem de outros gases. Compreender essas propriedades é crucial para diversas aplicações, desde a medicina até a indústria. Neste tópico, mergulharemos nas peculiaridades do oxigênio, analisando seu estado físico, reatividade e comportamento em diferentes condições.
Estado Físico e Condições de Existência, Número Atômico Do Oxigênio
O oxigênio, em condições normais de temperatura e pressão (CNTP), encontra-se no estado gasoso. É um gás incolor, inodoro e insípido, essencial para a respiração e inúmeros processos químicos. Sua forma molecular é O 2, consistindo de duas moléculas de oxigênio ligadas.
Ponto de Fusão, Ponto de Ebulição e Densidade
O oxigênio apresenta pontos de fusão e ebulição relativamente baixos, comparados a outros elementos. Isso se deve à sua estrutura molecular simples. A baixa densidade do oxigênio gasoso, comparada a outros gases, contribui para sua capacidade de ocupar grandes volumes.
| Propriedade | Valor | Unidade |
|---|---|---|
| Ponto de Fusão | -218,79 | °C |
| Ponto de Ebulição | -182,97 | °C |
| Densidade (a 0°C e 1 atm) | 1,429 | g/L |
Reatividade em Diferentes Condições
A reatividade do oxigênio é fortemente influenciada pela temperatura e pressão. Em altas temperaturas, o oxigênio torna-se mais reativo, promovendo reações de combustão mais vigorosas. A pressão também influencia a velocidade das reações envolvendo oxigênio.
Influência da Temperatura e Pressão
A temperatura e pressão impactam significativamente as propriedades físicas do oxigênio. Aumentos na temperatura aumentam a energia cinética das moléculas, favorecendo reações químicas. Aumentos na pressão, por sua vez, reduzem o volume ocupado pelo gás, aproximando as moléculas e potencializando as interações entre elas.
Comparação com Outros Gases
O oxigênio, apesar de essencial, difere de outros gases quanto à reatividade e densidade. Comparado ao nitrogênio, por exemplo, o oxigênio apresenta maior reatividade em certas condições. O hidrogênio, por outro lado, possui densidade significativamente menor.
Aplicações Práticas
O oxigênio desempenha um papel crucial em diversas aplicações práticas. É utilizado na medicina para auxiliar na respiração de pacientes com dificuldades respiratórias. Na indústria, o oxigênio é fundamental em processos como soldagem, corte de metais e fabricação de aço. A respiração humana é uma aplicação prática intrínseca e vital.
Exemplos de Aplicações
A utilização de oxigênio em ambientes confinados, como tanques de mergulho, garante a disponibilidade do gás vital para os mergulhadores.
O oxigênio também é utilizado na produção de combustíveis sintéticos, como metanol, demonstrando sua importância em processos industriais. É essencial para a produção de energia e diversas reações químicas.
Propriedades Químicas do Oxigênio: Número Atômico Do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, demonstra uma reatividade notável, interagindo com uma ampla gama de substâncias. Sua capacidade de formar ligações químicas e participar de diversas reações o torna um componente crucial em processos biológicos e industriais. Vamos mergulhar nas fascinantes propriedades químicas desse elemento vital!O oxigênio, devido à sua alta eletronegatividade, tende a ganhar elétrons, formando ligações covalentes com outros elementos.
Essa característica determina a formação de uma variedade de compostos, que veremos a seguir. Sua reatividade é influenciada por fatores como temperatura e pressão, e varia em comparação com outros elementos, tornando-o um elemento dinâmico e crucial em diversas reações.
Reações Químicas do Oxigênio
O oxigênio é um agente oxidante poderoso. Ele reage com a maioria dos elementos, exceto gases nobres, em condições apropriadas, formando óxidos. Essas reações podem ser exotérmicas, liberando energia na forma de calor e luz, como em uma combustão.
- Combustão: Um exemplo clássico de reação química envolvendo o oxigênio é a combustão. Nesse processo, uma substância reage com o oxigênio, liberando calor e luz. A queima de madeira, gasolina e gás natural são exemplos de reações de combustão, onde o oxigênio é o agente oxidante. A reação geral é: Combustível + Oxigênio → Produtos de combustão + Energia.
- Formação de Óxidos: O oxigênio reage com metais e não metais para formar óxidos. A reação com metais pode variar desde a formação de óxidos básicos, como o óxido de sódio (Na 2O), até a formação de óxidos ácidos, como o dióxido de carbono (CO 2). A reação com não metais, como o carbono, também resulta em óxidos, como o monóxido de carbono (CO) e o dióxido de carbono (CO 2).
- Reações com Outros Elementos: O oxigênio reage com outros elementos em diferentes condições, resultando em uma grande variedade de produtos. A reação com enxofre, por exemplo, gera dióxido de enxofre (SO 2), um gás poluente. A reação do oxigênio com fósforo resulta em uma reação de combustão rápida, liberando calor e luz.
Tipos de Compostos Formados pelo Oxigênio
O oxigênio, em suas reações, forma uma grande variedade de compostos. A maioria desses compostos são óxidos, que podem ser ácidos ou básicos, dependendo da natureza do elemento com o qual o oxigênio reage.
- Óxidos Ácidos: Alguns óxidos, como o dióxido de carbono (CO 2) e o dióxido de enxofre (SO 2), são ácidos quando dissolvidos em água. Eles formam soluções ácidas, como a água com gás carbônico.
- Óxidos Básicos: Outros óxidos, como o óxido de sódio (Na 2O) e o óxido de cálcio (CaO), são básicos quando dissolvidos em água. Eles formam soluções alcalinas, que são o oposto de soluções ácidas.
- Peróxidos: Existem também peróxidos, como o peróxido de hidrogênio (H 2O 2), que contêm o grupo peróxido (O 22-). Eles exibem propriedades oxidantes.
Comparação da Reatividade do Oxigênio com Outros Elementos
A reatividade do oxigênio varia em comparação com outros elementos, dependendo de fatores como a eletronegatividade e a estrutura atômica do elemento em questão. Elementos mais eletronegativos, como o flúor, tendem a ter uma reatividade maior do que o oxigênio. Sua reatividade também depende das condições de temperatura e pressão.
| Elemento | Eletronegatividade | Reatividade com Oxigênio |
|---|---|---|
| Flúor | 4.0 | Muito alta |
| Oxigênio | 3.5 | Alta |
| Cloro | 3.0 | Moderada |
| Bromo | 2.8 | Baixa |
Importância do Oxigênio na Respiração
A respiração é um processo vital para a maioria dos organismos vivos. O oxigênio é essencial nesse processo, atuando como um agente oxidante para a quebra de nutrientes, liberando energia para as atividades celulares.
- Processo Celular: O oxigênio é utilizado nas mitocôndrias das células para a respiração celular, um processo que quebra a glicose para liberar energia na forma de ATP (adenosina trifosfato), essencial para as funções vitais.
- Produção de Energia: A respiração celular aeróbica, que utiliza oxigênio, é muito mais eficiente na produção de energia do que a respiração anaeróbica, que não utiliza oxigênio.
- Manutenção da Vida: A disponibilidade de oxigênio é fundamental para a manutenção da vida, pois fornece a energia necessária para todas as funções vitais dos organismos.
Aplicações do Oxigênio
Source: z-dn.net
O oxigênio, elemento essencial para a vida na Terra, desempenha um papel crucial em inúmeras aplicações, desde processos industriais até procedimentos médicos. Sua alta reatividade o torna um agente oxidante vital em diversas reações químicas. Este elemento, fundamental para a respiração e a combustão, é explorado em diferentes setores, cada um com necessidades específicas de pureza e aplicação.
Aplicações na Indústria
O oxigênio é amplamente utilizado em processos industriais, impulsionando a eficiência e a produtividade. Sua aplicação como oxidante permite a otimização de reações químicas, permitindo a obtenção de produtos desejados com maior rapidez e eficiência.
- Incineração de Resíduos: A incineração de resíduos utiliza oxigênio para acelerar a combustão, convertendo materiais orgânicos em cinzas e gases, reduzindo o volume de resíduos e minimizando a contaminação ambiental. A pureza do oxigênio utilizada pode variar dependendo do tipo de resíduo, mas geralmente é superior a 99,5%. O uso de oxigênio puro em vez de ar atmosférico aumenta a eficiência da incineração, reduzindo o tempo de processamento e as emissões de gases poluentes.
- Produção de Aço: Na produção de aço, o oxigênio é fundamental para a remoção de impurezas, como carbono e enxofre, do minério de ferro. A reação química envolvida é crucial para a obtenção de aço com as propriedades desejadas. O uso de oxigênio em altos fornos permite uma maior eficiência energética e um controle mais preciso do processo, resultando em um produto final de alta qualidade.
- Soldagem: A soldagem a arco utiliza oxigênio para aumentar a temperatura do arco, permitindo a fusão dos metais a serem unidos. A pureza do oxigênio é crucial para a qualidade da solda, minimizando as inclusões de impurezas e garantindo uma ligação forte e resistente.
- Combustão de Motores: O oxigênio é fundamental para a combustão em motores, fornecendo o comburente necessário para a queima do combustível. O uso de oxigênio puro pode aumentar a eficiência dos motores, reduzindo a emissão de poluentes e melhorando o desempenho. A pureza do oxigênio utilizada varia dependendo do tipo de motor.
- Tratamento de Água: O oxigênio é empregado no tratamento de água para promover a oxidação de compostos orgânicos e inorgânicos presentes na água, melhorando a qualidade da água e eliminando contaminantes. A adição de oxigênio aumenta a eficácia do processo de oxidação biológica, permitindo um tratamento mais eficiente e sustentável.
Aplicações na Medicina
O oxigênio desempenha um papel vital em contextos médicos, fornecendo suporte respiratório e tratamento para pacientes com dificuldades respiratórias. A administração de oxigênio pode ser realizada por diferentes métodos, cada um com suas vantagens e desvantagens.
- Tratamento de Pacientes com Dificuldades Respiratórias: A administração de oxigênio é essencial para pacientes com dificuldades respiratórias, auxiliando a oxigenar o sangue e melhorar a função pulmonar. A administração de oxigênio pode ser realizada através de máscaras, cateteres nasais ou outros métodos, dependendo da gravidade da condição do paciente.
- Cirurgias: Em cirurgias, o oxigênio é usado para manter os níveis de oxigênio no sangue dos pacientes durante o procedimento, garantindo a adequada função dos tecidos e órgãos. A administração de oxigênio durante a cirurgia é crucial para minimizar o estresse oxidativo e evitar danos aos tecidos.
- Suporte Respiratório: Em situações de insuficiência respiratória, o oxigênio é fundamental para manter os níveis adequados de oxigênio no sangue, permitindo a respiração do paciente. Existem diversos equipamentos para administrar oxigênio, como cilindros de oxigênio, concentradores de oxigênio e sistemas de ventilação mecânica.
Aplicações em Outras Áreas Científicas
O oxigênio desempenha um papel importante em diversas áreas científicas, desde a pesquisa científica até a análise de materiais. Sua presença e reatividade são fundamentais em vários processos.
- Pesquisa Científica: O oxigênio é amplamente utilizado em experimentos científicos, principalmente em estudos que envolvem combustão e reações químicas. A pureza do oxigênio é crucial para garantir resultados precisos e confiáveis.
- Fotossíntese: O oxigênio é um subproduto essencial da fotossíntese, processo realizado por plantas e outros organismos fotossintéticos. O oxigênio liberado é crucial para a respiração dos organismos aeróbicos.
- Processos Químicos em Laboratório: O oxigênio é frequentemente usado em reações químicas em laboratório, agindo como oxidante em diversas transformações químicas. A utilização de oxigênio em laboratório depende da reação química e da pureza desejada.
- Análise de Materiais: A análise de materiais pode envolver a utilização de oxigênio para determinar as propriedades químicas e físicas dos materiais. A presença ou ausência de oxigênio pode indicar a composição e o estado do material.
Tabela de Aplicações Principais
| Aplicação | Descrição | Setor | Exemplo Concreto |
|---|---|---|---|
| Incineração de Resíduos | Acelera a combustão de resíduos orgânicos. | Gestão de Resíduos | Incineração de resíduos hospitalares. |
| Produção de Aço | Remoção de impurezas do minério de ferro. | Metalurgia | Produção de aço em altos fornos. |
| Soldagem | Aumenta a temperatura do arco para fusão dos metais. | Construção/Manutenção | Soldagem de peças metálicas. |
| Combustão de Motores | Fornece o comburente para a queima do combustível. | Automotivo/Indústria | Combustão em motores de combustão interna. |
| Tratamento de Água | Oxidação de compostos orgânicos e inorgânicos. | Saneamento | Tratamento de efluentes industriais. |
| Medicina | Suporte respiratório em pacientes com dificuldades respiratórias. | Saúde | Administração de oxigênio em pacientes com enfisema. |
Isótopos do Oxigênio
O oxigênio, elemento essencial para a vida, apresenta-se na natureza em diferentes formas, chamadas isótopos. Cada isótopo possui o mesmo número de prótons, mas um número diferente de nêutrons. Essas pequenas diferenças em sua composição nuclear podem impactar ligeiramente as propriedades físicas e químicas do elemento, mesmo que não alterem sua identidade química. Vamos explorar as peculiaridades de cada isótopo do oxigênio.
Variedades Isotópicas do Oxigênio
Os isótopos do oxigênio são três: 16O, 17O e 18O. Cada um deles possui oito prótons, mas diferem no número de nêutrons, sendo 8, 9 e 10, respectivamente. Essas diferenças sutis na estrutura nuclear resultam em propriedades ligeiramente distintas, apesar de serem todos oxigênio.
Características dos Isótopos
Cada isótopo apresenta características próprias, influenciando sua estabilidade e reatividade. A abundância relativa de cada um reflete sua estabilidade e a história da formação do sistema solar.
- 16O: O isótopo mais abundante, representando cerca de 99,76% do oxigênio encontrado na natureza. Sua estabilidade contribui para sua alta prevalência. Sua massa atômica é de aproximadamente 15,999 u.
- 17O: Este isótopo, com uma abundância de aproximadamente 0,037%, possui um número atômico de 8 e massa atômica de 16,999 u. Sua presença, apesar da baixa abundância, é crucial para estudos científicos.
- 18O: Com uma abundância de aproximadamente 0,20%, o 18O tem um número atômico de 8 e massa atômica de 17,999 u. Sua proporção com outros isótopos é fundamental em diversas áreas científicas.
Abundância Relativa
A abundância relativa dos isótopos do oxigênio é um fator crucial em diversos estudos científicos. As diferentes proporções de isótopos de oxigênio em amostras naturais podem fornecer informações sobre a história geológica e ambiental de uma região.
| Isótopo | Símbolo | Número de Prótons | Número de Nêutrons | Abundância (%) |
|---|---|---|---|---|
| Oxigênio-16 | 16O | 8 | 8 | 99,76 |
| Oxigênio-17 | 17O | 8 | 9 | 0,037 |
| Oxigênio-18 | 18O | 8 | 10 | 0,20 |
Representação Gráfica dos Isótopos
Imagine três círculos representando os três isótopos do oxigênio. O círculo maior, representando o 16O, seria significativamente maior, refletindo sua alta abundância. Os círculos menores, correspondentes a 17O e 18O, seriam proporcionalmente menores, indicando suas menores abundâncias. A proporção dos tamanhos dos círculos representa a abundância relativa de cada isótopo.
Número Atômico e Configurações Eletrônicas

Source: com.br
O número atômico do oxigênio, 8, revela a identidade do elemento e, fundamentalmente, a estrutura de sua nuvem eletrônica. Compreender a configuração eletrônica é crucial para prever as propriedades químicas e a reatividade do oxigênio. Esta estrutura, como um mapa da distribuição dos elétrons em torno do núcleo, permite prever como o oxigênio interage com outros elementos.A configuração eletrônica do oxigênio, ao descrever a ocupação dos níveis de energia pelos elétrons, nos permite compreender por que o oxigênio forma ligações químicas específicas e apresenta certas características.
Ela é a chave para desvendar as propriedades químicas únicas desse elemento essencial para a vida.
Configuração Eletrônica Detalhada
A distribuição dos elétrons nos átomos segue regras específicas, ditadas pelos princípios da mecânica quântica. O número atômico 8 do oxigênio determina que ele possui 8 elétrons. A configuração eletrônica descreve como esses 8 elétrons ocupam os diferentes níveis de energia ao redor do núcleo.
| Nível de Energia | Subnível | Número de Elétrons |
|---|---|---|
| 1 | 1s | 2 |
| 2 | 2s | 2 |
| 2 | 2p | 4 |
Essa tabela apresenta a distribuição detalhada dos 8 elétrons do oxigênio nos níveis e subníveis de energia. Os elétrons preenchem os níveis e subníveis de menor energia primeiro, seguindo o princípio da exclusão de Pauli e a regra de Hund.
Representação Gráfica da Estrutura Eletrônica
A estrutura eletrônica do oxigênio pode ser visualizada como uma série de camadas concêntricas em torno do núcleo. A primeira camada, mais próxima do núcleo, representa o nível de energia mais baixo e é composta por dois elétrons. A segunda camada, mais afastada do núcleo, contém os seis elétrons restantes, distribuídos em subníveis.
Imagine o núcleo do átomo como um ponto central. Em torno dele, desenhe duas esferas concêntricas, representando os níveis de energia. A primeira esfera, menor, representa o nível 1, contendo dois elétrons (representados como pontos dentro da esfera). A segunda esfera, maior, representa o nível 2, com quatro elétrons distribuídos em diferentes subníveis (por exemplo, dois elétrons no subnível 2s e dois no subnível 2p).
Os elétrons no subnível 2p são representados como pontos dentro de um formato de halteres.
Níveis de Energia dos Elétrons
Os níveis de energia dos elétrons do oxigênio são quantizados, ou seja, só podem assumir valores específicos. O nível 1 possui energia mais baixa e está mais próximo do núcleo. O nível 2 possui energia mais alta e está mais afastado do núcleo. A distribuição dos elétrons nesses níveis é fundamental para compreender as propriedades químicas do oxigênio.
A energia dos elétrons é quantizada, ou seja, pode assumir apenas certos valores discretos, não um valor contínuo.
A distribuição dos elétrons em diferentes níveis e subníveis de energia é o que determina a reatividade do oxigênio e sua capacidade de formar ligações químicas. A energia dos elétrons influencia a forma como eles interagem com outros átomos e moléculas.
Ligações Químicas do Oxigênio
Source: tabelaperiodica.org
O oxigênio, elemento essencial para a vida, forma uma variedade de ligações químicas, desempenhando papéis cruciais em diversas reações e compostos. Compreender essas ligações é fundamental para entender a química da vida e de muitos processos industriais. Neste mergulho, vamos explorar os diferentes tipos de ligações que o oxigênio estabelece, sua polaridade e como elas se comparam a outras ligações químicas.
Vamos também analisar exemplos de moléculas em que o oxigênio participa, e organizar tudo isso em um diagrama e tabela para facilitar a compreensão.O oxigênio, com sua alta eletronegatividade, tem uma tendência marcante de formar ligações covalentes com outros elementos. Essas ligações, em muitos casos, são polares, o que afeta significativamente as propriedades das moléculas resultantes. Vamos analisar como essa característica afeta as interações entre átomos e moléculas.
Tipos de Ligações Químicas do Oxigênio
O oxigênio, com seis elétrons na camada de valência, geralmente forma ligações covalentes, compartilhando elétrons com outros átomos para atingir a estabilidade. Essas ligações podem ser simples, duplas ou triplas, dependendo do número de pares de elétrons compartilhados. A polaridade dessas ligações é determinada pela diferença de eletronegatividade entre os átomos envolvidos.
Polaridade das Ligações
A polaridade de uma ligação covalente depende da diferença de eletronegatividade entre os átomos que a formam. O oxigênio é um elemento altamente eletronegativo. Quando o oxigênio se liga a átomos menos eletronegativos, a ligação resultante tende a ser polar, com o oxigênio adquirindo uma carga parcial negativa e o outro átomo uma carga parcial positiva. Essa polaridade é crucial para a formação de interações intermoleculares, como pontes de hidrogênio, que são fundamentais para as propriedades físicas das moléculas.
A diferença de eletronegatividade influencia diretamente a polaridade da ligação, e isso é determinante para as propriedades físico-químicas das moléculas resultantes.
Comparação com Outros Elementos
A tendência do oxigênio em formar ligações covalentes e polares difere ligeiramente da de outros elementos. Por exemplo, o nitrogênio, também altamente eletronegativo, forma ligações covalentes e polares, mas em proporções e com características diferentes. A comparação entre o oxigênio e outros elementos, como o carbono, revela as nuances das ligações químicas, mostrando como a eletronegatividade e a estrutura atômica influenciam a formação de moléculas.
A comparação permite entender como o oxigênio, em relação a outros elementos, participa da formação de diferentes tipos de moléculas.
Exemplos de Moléculas com Oxigênio
O oxigênio é um componente essencial em inúmeras moléculas importantes. Um exemplo é a água (H 2O), onde o oxigênio forma ligações covalentes polares com dois átomos de hidrogênio. Outro exemplo é o dióxido de carbono (CO 2), onde o oxigênio forma ligações duplas com o carbono. Esses exemplos ilustram a versatilidade do oxigênio na formação de moléculas com propriedades diversas.
Diagrama de Ligações Químicas
O oxigênio forma ligações químicas com uma variedade de elementos, incluindo hidrogênio, carbono, nitrogênio, enxofre e outros. Essas ligações são representadas graficamente, mostrando a estrutura de Lewis, que ilustra a distribuição dos elétrons nas ligações químicas. Um diagrama detalhado demonstraria a estrutura de Lewis e as ligações para várias moléculas de oxigênio.
Tabela de Tipos de Ligações
| Tipo de Ligação | Descrição | Exemplo |
|---|---|---|
| Covalente Simples | Compartilhamento de um par de elétrons | H2O (água) |
| Covalente Dupla | Compartilhamento de dois pares de elétrons | CO2 (dióxido de carbono) |
| Covalente Polar | Compartilhamento desigual de elétrons devido a diferença de eletronegatividade | H2O (água) |
Ocorrência Natural do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, é amplamente distribuído na natureza em diversas formas. Sua presença é essencial para inúmeros processos vitais, desde a respiração até a combustão. Este texto detalha a ocorrência natural do oxigênio, sua importância na atmosfera e na manutenção da vida, apresentando exemplos e um diagrama de fluxo do ciclo natural do oxigênio.A abundância e diversidade de formas de ocorrência do oxigênio tornam-no crucial para o funcionamento dos ecossistemas terrestres.
Ocorrência do Oxigênio na Natureza
O oxigênio é encontrado em diferentes formas na natureza, desempenhando papéis cruciais em vários ciclos biogeoquímicos. Sua presença varia em diferentes esferas da Terra, incluindo a atmosfera, hidrosfera, litosfera e na biomassa.
- Atmosférico: O oxigênio é o segundo componente mais abundante na atmosfera terrestre, representando aproximadamente 20,95% em volume. Esta concentração é vital para a respiração aeróbica da maioria dos organismos vivos.
- Hidroesférico: O oxigênio também se encontra dissolvido na água, sendo essencial para a respiração aquática. A solubilidade do oxigênio na água depende de fatores como temperatura e salinidade. A concentração de oxigênio dissolvido em corpos d’água afeta a vida aquática.
- Litosférico: O oxigênio é um elemento abundante na litosfera, combinando-se com outros elementos para formar diversos minerais e rochas. O óxido de ferro, por exemplo, é um composto comum formado pela combinação de oxigênio e ferro.
- Biomassa: Organismos vivos contêm oxigênio em suas estruturas moleculares. Em seres vivos, o oxigênio está presente em compostos orgânicos essenciais, como água e proteínas.
Importância do Oxigênio na Atmosfera
A presença de oxigênio na atmosfera é crucial para a vida na Terra. Sua participação em processos fundamentais, como respiração, combustão, formação de ozônio e ciclo do carbono, é essencial para a manutenção dos ecossistemas.
- Respiração: A respiração aeróbica, um processo fundamental para a maioria dos organismos, requer oxigênio para extrair energia dos nutrientes. O oxigênio atua como um aceitador final de elétrons na cadeia respiratória, liberando energia necessária para o funcionamento celular.
- Combustão: O oxigênio é essencial para a combustão, um processo químico que libera energia. A queima de madeira, combustíveis fósseis e outros materiais requer oxigênio para a reação.
- Formação de Ozônio: A camada de ozônio na estratosfera absorve a radiação ultravioleta (UV) nociva do sol. O oxigênio é crucial na formação do ozônio, uma molécula triatômica de oxigênio que protege a vida na Terra dos efeitos prejudiciais da radiação UV.
- Ciclo do Carbono: O oxigênio está intimamente ligado ao ciclo do carbono. A fotossíntese, realizada pelas plantas, utiliza dióxido de carbono e água, liberando oxigênio como subproduto. Este processo é fundamental para a regulação da concentração de dióxido de carbono na atmosfera.
Porcentagem de Oxigênio na Atmosfera
A porcentagem de oxigênio na atmosfera terrestre é de aproximadamente 20,95%.
Exemplos de Processos Naturais Envolvendo Oxigênio
O oxigênio desempenha um papel crucial em diversos processos naturais.
- Fotossíntese: Nas plantas, a fotossíntese utiliza a energia solar para converter dióxido de carbono e água em açúcares, liberando oxigênio como subproduto. Esse processo é fundamental para a produção de alimentos e para a manutenção da vida na Terra.
- Decomposição: A decomposição da matéria orgânica, como folhas e animais mortos, envolve reações químicas que utilizam oxigênio para decompor os compostos orgânicos em substâncias mais simples.
- Respiração de Animais e Plantas: Animais e plantas realizam respiração, processo que utiliza oxigênio para liberar energia dos alimentos, produzindo dióxido de carbono como subproduto. A respiração celular é essencial para o funcionamento de todos os organismos.
- Formação de Compostos Químicos: O oxigênio participa da formação de inúmeros compostos químicos, como óxidos, ácidos e bases. A água (H 2O), por exemplo, é um composto crucial que contém oxigênio.
Importância do Oxigênio para a Vida na Terra
O oxigênio é essencial para a vida na Terra, pois é fundamental para a respiração aeróbica da maioria dos organismos. Sem oxigênio, a maioria dos processos vitais não seria possível. A disponibilidade de oxigênio na atmosfera e em corpos d’água é um fator determinante para a distribuição e abundância de diferentes grupos de organismos.
Ciclo Natural do Oxigênio
O ciclo do oxigênio é um ciclo biogeoquímico que descreve o movimento do oxigênio através da atmosfera, hidrosfera, litosfera e biosfera. O diagrama a seguir ilustra as principais etapas desse ciclo. 
O Número Atômico e a Tabela Periódica
A tabela periódica é uma das ferramentas mais importantes da química. Ela organiza os elementos químicos de forma sistemática, revelando relações entre suas propriedades e comportamentos. Compreender a posição de um elemento na tabela periódica é fundamental para prever suas características e interações com outros elementos. O número atômico desempenha um papel crucial nessa organização.A organização dos elementos na tabela periódica não é aleatória.
Ela reflete as semelhanças e diferenças nas propriedades dos elementos, baseadas em sua estrutura atômica, principalmente no número de prótons em seus núcleos. Esta organização permite que os químicos prevejam e compreendam as reações químicas e as propriedades dos elementos, facilitando a busca por novos materiais e aplicações.
Significância do Número Atômico na Tabela Periódica
O número atômico de um elemento, representado pelo símbolo Z, indica o número de prótons presentes no núcleo de um átomo desse elemento. É um valor fundamental, pois determina a identidade do elemento. Elementos diferentes têm diferentes números atômicos. Por exemplo, o hidrogênio (H) tem número atômico 1, o hélio (He) tem número atômico 2, e assim por diante.
Organização dos Elementos na Tabela Periódica
A tabela periódica organiza os elementos em linhas (períodos) e colunas (grupos) com base em suas propriedades químicas e físicas. A posição de um elemento na tabela fornece informações sobre sua estrutura eletrônica, o que influencia suas propriedades químicas. Elementos com propriedades semelhantes são agrupados em colunas (grupos), e os períodos refletem o preenchimento progressivo das camadas eletrônicas.
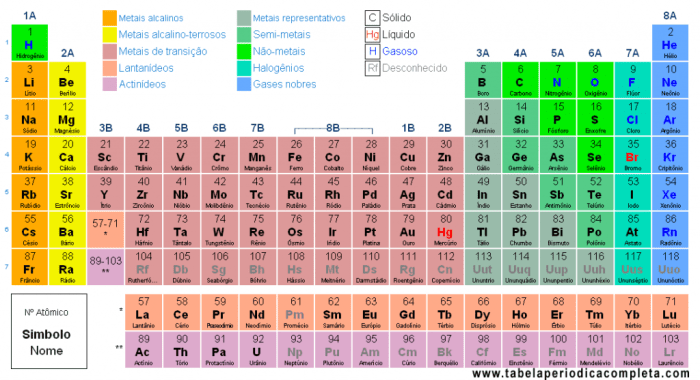
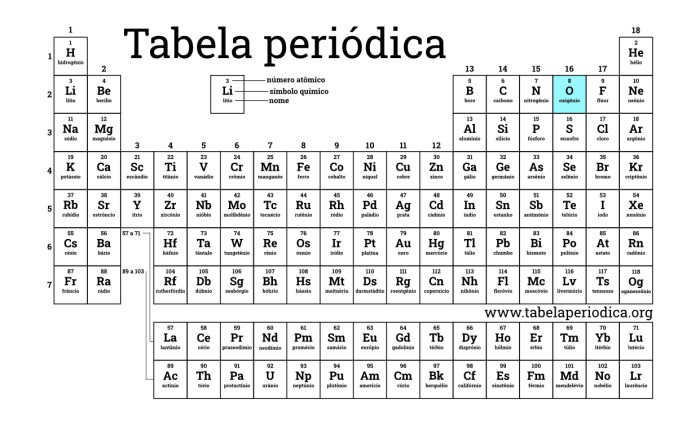
Posição do Oxigênio na Tabela Periódica
| Grupo | Período | Número Atômico | Símbolo |
|---|---|---|---|
| 16 | 2 | 8 | O |
O oxigênio (O) encontra-se no grupo 16 e no período 2 da tabela periódica. Essa posição reflete a estrutura eletrônica do átomo de oxigênio, que possui 8 prótons e 8 elétrons.
Relações entre Posição e Propriedades do Oxigênio
A posição do oxigênio na tabela periódica está diretamente relacionada às suas propriedades. Sendo um não metal, o oxigênio apresenta alta eletronegatividade, o que significa que ele tem uma forte tendência a atrair elétrons em uma ligação química. Essa característica é fundamental para a formação de moléculas de água (H₂O) e outras substâncias essenciais à vida. A sua posição no grupo 16 também indica sua capacidade de formar compostos iônicos com metais.
Grupo e Período do Oxigênio
O oxigênio pertence ao grupo 16 (calcogênios), que inclui elementos como enxofre (S), selênio (Se), telúrio (Te) e polônio (Po). Os elementos desse grupo têm propriedades químicas semelhantes, incluindo a capacidade de formar compostos com hidrogênio. O oxigênio, estando no segundo período, indica que seus elétrons ocupam as duas primeiras camadas eletrônicas.
Representação Visual da Tabela Periódica com Destaque do Oxigênio
Imagine uma tabela periódica colorida, com os elementos organizados em períodos e grupos. O oxigênio seria destacado com uma cor mais vibrante, possibilitando uma visualização clara de sua posição. Essa representação visual facilita a compreensão da estrutura e das relações entre os elementos químicos.
Importância do Oxigênio na Vida

Source: com.br
O oxigênio é um elemento fundamental para a vida na Terra, desempenhando um papel crucial em inúmeros processos biológicos. Sua presença é essencial para a existência e o funcionamento de organismos vivos, desde os mais simples até os mais complexos. A capacidade do oxigênio de participar em reações químicas que liberam energia é a base da maioria das atividades metabólicas.O oxigênio é um elemento vital para a manutenção da vida, pois participa de reações que liberam energia necessária para as funções celulares.
Sua presença na atmosfera permitiu o surgimento de organismos complexos capazes de realizar processos metabólicos mais eficientes.
Papel do Oxigênio na Respiração
O oxigênio é essencial no processo respiratório, particularmente na respiração aeróbica. Nesse processo, o oxigênio atua como o aceptor final de elétrons na cadeia respiratória, permitindo a liberação de energia armazenada nas moléculas orgânicas. A respiração aeróbica é mais eficiente na produção de energia do que a respiração anaeróbica, resultando na produção de ATP, a moeda energética das células.
A respiração aeróbica envolve uma série de reações químicas que quebram as moléculas de glicose e outras substâncias orgânicas, liberando energia. O oxigênio é crucial para a etapa final deste processo.
Exemplos de Processos Biológicos que Dependem do Oxigênio
Diversos processos biológicos dependem diretamente do oxigênio. A fotossíntese, por exemplo, é um processo que utiliza a energia da luz solar para converter dióxido de carbono e água em açúcares, liberando oxigênio como subproduto. O metabolismo de proteínas e a reparação do DNA também exigem a presença de oxigênio para funcionar adequadamente. A ausência de oxigênio compromete a eficiência e a viabilidade desses processos.
Impacto da Deficiência de Oxigênio
A falta de oxigênio, ou hipóxia, pode ter consequências severas para os organismos vivos. Em nível celular, a hipóxia pode levar a danos celulares e até mesmo à morte celular. Em nível tecidual, a falta de oxigênio pode causar danos irreversíveis aos tecidos, afetando suas funções. Em nível orgânico, a deficiência de oxigênio pode resultar em doenças e condições graves, como insuficiência respiratória e problemas cardíacos.
A altitude elevada, o envenenamento por monóxido de carbono e certas doenças respiratórias são exemplos de situações que podem levar à deficiência de oxigênio.
Relação entre Oxigênio e Produção de Energia
A produção de energia em um organismo está diretamente relacionada à quantidade de oxigênio consumido. A respiração aeróbica é altamente eficiente na produção de ATP, a principal forma de energia usada pelas células. A quantidade de oxigênio consumido reflete a taxa metabólica do organismo. Um aumento no consumo de oxigênio indica um aumento na taxa metabólica.
Fluxograma da Respiração Celular
O fluxograma a seguir ilustra o papel do oxigênio na respiração celular, destacando as principais etapas e intermediários:
Início
[Entrada de glicose] --> [Glicólise] --> [2 Piruvatos]
|
V
[Ciclo de Krebs] --> [Transporte de elétrons]
|
V
[Fosforilação Oxidativa] --> [ATP]
|
V
Saída
[CO2]
[H2O]
O oxigênio atua como o aceptor final de elétrons na cadeia respiratória, permitindo a formação de água e a liberação de uma grande quantidade de energia na forma de ATP.
Segurança com Oxigênio
O oxigênio, essencial à vida, apresenta riscos quando utilizado em concentrações elevadas ou em ambientes inadequados. Procedimentos de segurança rigorosos são imprescindíveis para evitar acidentes e garantir a saúde dos trabalhadores. Esta seção detalha os perigos potenciais, precauções, diretrizes de armazenamento e transporte, bem como os riscos de exposição ao oxigênio.
O manuseio seguro do oxigênio requer conhecimento e atenção aos potenciais perigos, desde a combustão intensificada até as explosões, passando pelas reações químicas e impactos na saúde humana. A compreensão desses riscos e a aplicação de medidas preventivas são cruciais para garantir um ambiente de trabalho seguro.
Perigos Potenciais Relacionados ao Oxigênio
O oxigênio, embora vital, pode ser extremamente perigoso se não for manipulado adequadamente. Suas propriedades intensificam a combustão e tornam as explosões mais prováveis.
- Combustão: O oxigênio é um oxidante poderoso. Sua presença aumenta significativamente a taxa de combustão, podendo transformar um incêndio moderado em uma situação explosiva. Materiais inflamáveis, como papel, madeira, tecidos e solventes orgânicos, reagem mais vigorosamente na presença de oxigênio puro. O contato com combustíveis, como gasolina, querosene e álcool, pode levar a incêndios intensos e difíceis de controlar.
- Explosões: A presença de oxigênio puro em concentrações elevadas aumenta o risco de explosões. Fontes de ignição, como faíscas elétricas, calor ou chamas, podem desencadear reações explosivas em materiais combustíveis. A concentração de oxigênio e a quantidade de material inflamável presentes afetam a magnitude da explosão. Por exemplo, um pequeno vazamento de oxigênio puro em uma área com poeira de madeira pode causar uma explosão catastrófica.
- Suporte à Vida: A exposição a concentrações de oxigênio elevadas ou baixas pode afetar significativamente o corpo humano. A falta de oxigênio pode causar asfixia, enquanto concentrações muito altas podem levar a danos pulmonares e outros problemas de saúde.
- Reações Químicas: O oxigênio pode reagir com várias substâncias, levando a reações químicas potencialmente perigosas. Substâncias incompatíveis, como alguns metais e compostos orgânicos, podem reagir violentamente com o oxigênio, resultando em explosões ou incêndios.
Precauções ao Manusear Oxigênio
Medidas preventivas adequadas são fundamentais para garantir a segurança ao manusear oxigênio.
- Equipamento de Proteção Individual (EPI): O uso de EPI é crucial. Óculos de proteção, luvas resistentes a produtos químicos e roupas apropriadas são indispensáveis para proteger o usuário de contato direto com o oxigênio ou substâncias potencialmente perigosas. A escolha do EPI deve levar em conta a concentração de oxigênio e as substâncias presentes no ambiente.
- Ventilação Adequada: A ventilação adequada é essencial para evitar a acumulação de gases inflamáveis e garantir uma concentração de oxigênio segura. Em ambientes onde o oxigênio é usado, sistemas de ventilação eficazes são fundamentais para remover qualquer produto da reação ou gases perigosos e manter níveis de oxigênio adequados.
- Manutenção do Equipamento: A manutenção regular dos equipamentos de oxigênio, como cilindros e válvulas, é crucial para garantir seu funcionamento seguro e prevenir vazamentos ou falhas. A inspeção regular e a substituição de peças desgastadas são medidas importantes.
- Procedimentos de Emergência: É fundamental ter procedimentos de emergência definidos e praticados em caso de vazamento de oxigênio, incêndio ou outra situação de risco. Os procedimentos devem incluir a evacuação da área, a notificação de emergência e o uso adequado de equipamentos de combate a incêndio.
Diretrizes de Segurança para Armazenamento e Transporte
O armazenamento e transporte de cilindros de oxigênio devem seguir normas rigorosas para evitar acidentes.
- Armazenamento: Cilindros de oxigênio devem ser armazenados em locais frescos, secos e bem ventilados, longe de materiais inflamáveis. É essencial evitar danos físicos aos cilindros e monitorar regularmente a pressão interna.
- Transporte: Cilindros de oxigênio devem ser transportados de forma segura, de acordo com as normas regulamentares. A fixação adequada dos cilindros, a rotulagem clara e a conformidade com as regulamentações específicas para transporte rodoviário e aéreo são fundamentais.
- Recomendações de Rotulagem: Cilindros de oxigênio devem ser claramente rotulados com informações essenciais, incluindo o conteúdo, o nome do fabricante e as precauções necessárias. A rotulagem precisa e clara evita confusões e acidentes.
Riscos de Exposição ao Oxigênio
A exposição a concentrações inadequadas de oxigênio pode ter efeitos adversos à saúde.
- Efeitos Agudos: A exposição a altas concentrações de oxigênio pode causar danos aos pulmões e outros órgãos. É essencial manter a concentração de oxigênio dentro dos limites de segurança.
- Efeitos Crônicos: A exposição crônica a níveis elevados de oxigênio pode causar danos à visão, ao sistema nervoso e ao coração. Existem limites de exposição aceitáveis para prevenir tais problemas.
- Limites de Segurança: Os limites de segurança para a concentração de oxigênio no ambiente de trabalho são estabelecidos para proteger a saúde dos trabalhadores. O cumprimento desses limites é essencial.
Tabela de Procedimentos e Precauções
| Procedimento | Precaução | Risco Potencial |
|---|---|---|
| Uso de cilindros de oxigênio | Armazenamento em local fresco, seco e ventilado, longe de materiais inflamáveis. | Combustão, explosão |
| Manuseio de cilindros | Usar luvas e óculos de proteção. | Lesões por contato, danos aos olhos |
| Conexão de cilindros | Verificar a compatibilidade e a correta conexão das válvulas. | Vazamento de oxigênio |
Aplicações em diferentes Campos
O oxigênio, elemento fundamental para a vida, desempenha um papel crucial em inúmeros processos industriais e científicos. Sua versatilidade se manifesta em diferentes campos, impulsionando a inovação e o desenvolvimento tecnológico. Desde a respiração artificial até a fabricação de aço, o oxigênio revela sua importância em diversas aplicações, moldando a sociedade moderna.
Aplicações em Medicina
O oxigênio é essencial para a respiração humana. Em situações de emergência ou patologias respiratórias, o oxigênio suplementar é vital para manter a vida e a saúde. Equipamentos médicos, como respiradores artificiais e cilindros de oxigênio, são fundamentais para garantir o suprimento adequado de oxigênio aos pacientes. A terapia com oxigênio é utilizada para tratar diversas condições, desde asma até insuficiência respiratória aguda.
A utilização precisa e controlada de oxigênio em procedimentos cirúrgicos e anestésicos também garante o bem-estar do paciente. A administração precisa de oxigênio, através de diferentes métodos como máscaras faciais e tubos nasais, é crucial para o sucesso dos tratamentos. A eficácia da terapia com oxigênio é comprovada e amplamente utilizada em hospitais e clínicas ao redor do mundo.
Aplicações em Metalurgia
Na indústria metalúrgica, o oxigênio desempenha um papel fundamental na produção de aço. O processo de oxidação, utilizando o oxigênio, é crucial para a remoção de impurezas e a obtenção de um aço de alta qualidade. Fornos a oxigênio, como os fornos de arco elétrico, utilizam o oxigênio para acelerar a combustão e otimizar a produção de aço. Essa técnica permite reduzir o tempo de processamento e aumentar a eficiência da produção.
A utilização de oxigênio puro em fornos também permite a obtenção de aços com características específicas, como resistência e durabilidade, tornando-os ideais para diferentes aplicações industriais. A economia de energia e a melhoria da qualidade do produto final são benefícios significativos da utilização do oxigênio na metalurgia.
Aplicações em Aeroespacial
No setor aeroespacial, o oxigênio é essencial para o funcionamento dos foguetes e outros veículos espaciais. O oxigênio líquido é utilizado como oxidante nos propulsores, fornecendo o impulso necessário para o lançamento. A capacidade de armazenamento e transporte de oxigênio líquido, aliado à tecnologia de propulsão, é crucial para a exploração espacial. Os sistemas de suporte à vida em espaçonaves utilizam o oxigênio para a respiração dos astronautas.
A produção e o gerenciamento eficaz do oxigênio são vitais para garantir a segurança e o sucesso das missões espaciais. A busca por fontes de oxigênio sustentáveis em ambientes extraterrestres é uma área de pesquisa em desenvolvimento, com implicações significativas para a colonização espacial.
Aplicações em Agricultura
Na agricultura, o oxigênio é utilizado para melhorar a qualidade do solo e o desenvolvimento das culturas. A utilização de oxigênio em sistemas de irrigação pode otimizar a absorção de nutrientes pelas raízes, promovendo um crescimento mais vigoroso das plantas. A gestão do oxigênio no solo é essencial para a saúde das raízes, o que influencia diretamente na produção agrícola.
Em sistemas de cultivo hidropônico, o oxigênio é crucial para o crescimento das plantas em solução nutritiva, melhorando o desenvolvimento radicular e a produção de frutos. A adição controlada de oxigênio em sistemas de armazenamento de frutas e vegetais também prolonga a vida útil dos produtos, minimizando perdas pós-colheita.
Tabela Resumo das Aplicações
| Campo | Aplicações | Equipamentos/Tecnologias |
|---|---|---|
| Medicina | Respiração artificial, terapia com oxigênio, procedimentos cirúrgicos | Respiradores artificiais, cilindros de oxigênio, máscaras faciais |
| Metalurgia | Produção de aço, remoção de impurezas, otimização da produção | Fornos a oxigênio, fornos de arco elétrico |
| Aeroespacial | Propulsão de foguetes, suporte à vida em espaçonaves | Sistemas de propulsão, sistemas de suporte à vida |
| Agricultura | Melhora da qualidade do solo, desenvolvimento de culturas, armazenamento de produtos | Sistemas de irrigação, sistemas de cultivo hidropônico |
Impacto Econômico
O oxigênio desempenha um papel significativo na economia global, impulsionando setores como saúde, metalurgia, e aeroespacial. A produção e distribuição de oxigênio geram empregos e contribuem para o crescimento econômico. A eficiência e a otimização dos processos que utilizam o oxigênio impactam diretamente nos custos de produção e nos lucros de empresas. A inovação em tecnologias que utilizam oxigênio, como a produção de aço mais limpa e eficiente, impacta a economia global positivamente.
Diferenças entre Oxigênio e Outros Elementos
O oxigênio, elemento vital para a vida na Terra, apresenta características únicas que o distinguem de outros elementos da tabela periódica. Compreender essas diferenças é fundamental para elucidar suas propriedades e reações químicas, bem como sua importância em diversos processos biológicos e industriais. As peculiaridades do oxigênio, como sua alta eletronegatividade e capacidade de formar ligações covalentes fortes, definem sua participação em inúmeras reações químicas, contrastando com a diversidade de comportamentos observados em outros elementos.
Comparação Geral
As diferenças entre o oxigênio e outros elementos da tabela periódica são amplamente determinadas por suas propriedades atômicas, principalmente a eletronegatividade, número atômico, raio atômico, afinidade eletrônica e potencial de ionização. A comparação com elementos adjacentes e em grupos específicos revela nuances importantes nas propriedades físicas e químicas. Por exemplo, o oxigênio, com sua alta eletronegatividade, tende a formar ligações covalentes polares e compostos com maior tendência a interações intermoleculares, diferentemente de elementos menos eletronegativos.
Impacto nas Propriedades
Essas diferenças fundamentais influenciam diretamente as propriedades físicas e químicas do oxigênio. O oxigênio, em condições normais de temperatura e pressão, é um gás diatômico, enquanto outros elementos podem ser sólidos, líquidos ou gases. A alta eletronegatividade do oxigênio, por exemplo, contribui para sua alta capacidade de formar ligações fortes e para seus elevados pontos de ebulição e fusão em comparação com elementos menos eletronegativos.
A densidade, a condutividade elétrica e a reatividade também são afetadas por essas diferenças atômicas. A reatividade, em particular, é crucial para entender como o oxigênio participa de reações químicas.
Reações Químicas
O oxigênio é um elemento altamente reativo, participando em reações de combustão, formação de óxidos e outras interações químicas. A combustão, por exemplo, é uma reação rápida de oxidação que libera calor e luz. A formação de óxidos é uma reação de combinação entre o oxigênio e outros elementos, gerando compostos com diversas aplicações. A comparação com elementos semelhantes, como o enxofre e o nitrogênio, revela que a reatividade do oxigênio difere significativamente, influenciada por sua estrutura atômica e configuração eletrônica.
As equações químicas balanceadas demonstram as proporções dos reagentes e produtos nesses processos.
Estrutura Atômica e Configuração Eletrônica
A estrutura atômica do oxigênio, com 8 prótons, 8 elétrons e 8 nêutrons, e sua distribuição eletrônica, definem seu comportamento químico. A comparação com elementos como o enxofre, selênio e telúrio, da mesma família, demonstra como pequenas variações no número de elétrons e camadas eletrônicas afetam as propriedades. A configuração eletrônica completa do oxigênio, 1s 22s 22p 4, e dos elementos semelhantes fornecem um detalhamento mais preciso dessas diferenças, que são essenciais para prever o comportamento químico.
Exemplos Específicos
As reações de combustão do oxigênio, como a queima de madeira ou combustíveis fósseis, são exemplos claros da alta reatividade desse elemento. As equações químicas balanceadas ilustram as proporções dos reagentes e produtos. A formação de óxidos, por exemplo, a oxidação do ferro em presença de oxigênio, mostra a capacidade do oxigênio de se combinar com outros elementos.
A comparação com a formação de óxidos por outros elementos, como o enxofre, ilustra as diferenças nas estruturas e propriedades dos compostos resultantes. A comparação com metais e não metais demonstra a variabilidade na reatividade e nas propriedades dos compostos formados.
Tabela Comparativa
| Característica | Oxigênio | Enxofre | Fósforo |
|---|---|---|---|
| Número Atômico | 8 | 16 | 15 |
| Estado Físico (25°C) | Gasoso | Sólido | Sólido |
| Eletronegatividade | Alta | Moderada | Moderada |
| Reações Típicas | Combustão, formação de óxidos | Reações com metais, formação de óxidos | Reações com metais e não metais, formação de compostos |
| Estrutura Atômica | (Detalhe a estrutura atômica com diagrama) | (Detalhe a estrutura atômica com diagrama) | (Detalhe a estrutura atômica com diagrama) |
| Configuração Eletrônica | (Detalhe a configuração eletrônica) | (Detalhe a configuração eletrônica) | (Detalhe a configuração eletrônica) |
Curiosidades e Fatos Interessantes sobre o Oxigênio
O oxigênio, elemento essencial à vida na Terra, possui uma série de propriedades e aplicações fascinantes. Desde sua descoberta até seu papel crucial nos processos biológicos e industriais, o oxigênio guarda inúmeras curiosidades. Neste tópico, exploraremos fatos históricos, propriedades peculiares, aplicações pouco conhecidas, seu papel no universo e dados estatísticos relevantes sobre este elemento vital.
Histórico da Descoberta e Experimentação
A descoberta do oxigênio foi um processo gradual, envolvendo contribuições de diversos cientistas ao longo do tempo. Joseph Priestley, em 1774, é frequentemente creditado como o descobridor, ao isolar o gás através da decomposição de óxido de mercúrio. Entretanto, outros pesquisadores, como Carl Wilhelm Scheele, chegaram a resultados semelhantes, quase simultaneamente. O experimento de Cavendish, que demonstrou a produção de oxigênio a partir de óxido de mercúrio, utilizando métodos mais sofisticados, forneceu evidências cruciais para a compreensão das propriedades do gás.
- A descoberta do oxigênio foi um processo gradual, não atribuível a um único indivíduo. Priestley e Scheele, trabalhando independentemente, isolaram o gás quase ao mesmo tempo.
- O experimento de Cavendish, que envolvia a decomposição de óxido de mercúrio, foi crucial para a compreensão das propriedades do oxigênio, utilizando técnicas mais avançadas para a época.
- A importância da colaboração científica é destacada, pois a descoberta de elementos, como o oxigênio, muitas vezes resulta de um esforço coletivo de cientistas, com contribuições de diferentes perspectivas e metodologias.
Propriedades Físicas e Químicas Incomuns
O oxigênio, em seus diferentes estados físicos, exibe propriedades distintas e interessantes. A densidade do oxigênio varia significativamente entre o estado gasoso, líquido e sólido. Sua capacidade de formar ligações químicas com diversos elementos também é notável.
| Estado Físico | Densidade (aproximada) |
|---|---|
| Gasoso | 1,43 kg/m³ |
| Líquido | 1,141 kg/m³ |
| Sólido | 1,429 kg/m³ |
- A densidade do oxigênio líquido é ligeiramente menor que a do oxigênio gasoso, refletindo a diferença na organização molecular em cada estado físico.
- A capacidade do oxigênio de reagir com diversos elementos, formando óxidos, é fundamental em processos químicos e biológicos, como a respiração.
- A baixa densidade do oxigênio no estado gasoso contribui para sua ampla distribuição na atmosfera terrestre.
Aplicações e Usos Inesperados
O oxigênio, além de sua importância na respiração, encontra-se em aplicações industriais essenciais. Sua utilização na produção de aço, por exemplo, é crucial para a obtenção de um produto final de alta qualidade. Além disso, o oxigênio é fundamental em processos de soldagem, permitindo a união de metais com alta eficiência.
- O oxigênio desempenha um papel fundamental na produção de aço, melhorando a qualidade e a eficiência do processo.
- Sua utilização na soldagem permite a união de metais com alta precisão e eficiência, sendo imprescindível em diversas indústrias.
- O oxigênio líquido é utilizado como propelente em foguetes e outros veículos espaciais, devido à sua alta capacidade de armazenamento de energia.
Papel no Universo
O oxigênio é um elemento abundante no universo, sendo essencial para a formação de estrelas e planetas. A sua presença em diferentes formas de vida, incluindo bactérias, é crucial para a manutenção da vida.
- O oxigênio é um elemento fundamental na formação de estrelas e planetas, sendo um produto de reações nucleares no interior das estrelas.
- A presença de oxigênio em diferentes formas de vida, como bactérias, demonstra sua importância na manutenção de processos biológicos.
- O oxigênio desempenha um papel crucial na respiração celular em diversos organismos, incluindo animais e plantas.
Dados Estatísticos Relevantes
O oxigênio é um elemento abundante na atmosfera terrestre, representando aproximadamente 21% em volume. Sua presença é essencial para a vida na Terra.
- A atmosfera terrestre contém aproximadamente 21% de oxigênio em volume, sendo essencial para a respiração de diversos organismos.
- A abundância de oxigênio no universo é significativa, desempenhando um papel crucial na formação de estrelas e planetas.
- A importância do oxigênio para a vida na Terra é inegável, sendo fundamental para a respiração de animais e plantas.
Fatos Divertidos e Curiosos
O oxigênio, apesar de incolor e inodoro, desempenha um papel crucial em diversas reações químicas, incluindo a combustão. Sua importância na sociedade moderna é inquestionável.
- O oxigênio é fundamental para a queima de combustíveis, sendo imprescindível para diversas atividades humanas, como a geração de energia.
- A combustão, em diversas formas, é crucial para a sociedade moderna, sendo utilizada em processos industriais, geração de energia e transporte.
- A capacidade do oxigênio de sustentar a combustão demonstra sua importância para a evolução da tecnologia e o desenvolvimento da sociedade.
Em nossa exploração do Número Atômico do Oxigênio, descobrimos que esse elemento crucial, com seu número atômico 8, desempenha um papel fundamental em nossa existência. Da respiração à combustão, sua presença é essencial. Esperamos que esta jornada tenha sido esclarecedora e tenha proporcionado uma compreensão mais aprofundada sobre a importância desse elemento em nosso mundo.
Qual a importância do número atômico na identificação de um elemento?
O número atômico é a identidade de um elemento. Cada elemento possui um número único de prótons em seu núcleo, definindo suas propriedades e comportamento químico.
Quais os isótopos do oxigênio mais comuns?
Os isótopos mais comuns do oxigênio são o 16O, 17O e 18O. A maioria dos átomos de oxigênio encontrados na natureza são do tipo 16O.
Qual a importância do oxigênio na fotossíntese?
Na fotossíntese, as plantas absorvem dióxido de carbono e água, utilizando a energia solar para produzir glicose e liberar oxigênio. Esse processo é essencial para a vida na Terra, fornecendo oxigênio para a respiração.
O oxigênio é um metal ou um não-metal?
O oxigênio é um não-metal. Ele possui características distintas dos metais, como baixa condutividade elétrica e térmica.












