Numero Atomico Do Oxigenio – Com o Número Atômico do Oxigênio, embarcamos em uma jornada fascinante pela tabela periódica! Vamos desvendar o mistério por trás do elemento essencial para a vida na Terra. O oxigênio, com seu número atômico 8, desempenha um papel crucial em inúmeros processos, desde a respiração celular até reações químicas fundamentais. Prepare-se para mergulhar em detalhes sobre sua posição, propriedades e importância na química e biologia!
O número atômico do oxigênio, seu lugar na tabela periódica e sua relação com elementos adjacentes são temas que serão explorados com profundidade e clareza. Compreender essas conexões é essencial para desvendar os segredos da química e sua influência na vida em nosso planeta.
Aprimorado: Número Atômico do Oxigênio
Source: escuelaparticulararrayan.cl
O oxigênio, um elemento fundamental para a vida na Terra, possui um número atômico crucial para compreender suas propriedades e seu papel na tabela periódica. Sua posição e características químicas o destacam entre os demais elementos, permitindo uma análise aprofundada de suas interações e importância.
Número Atômico do Oxigênio
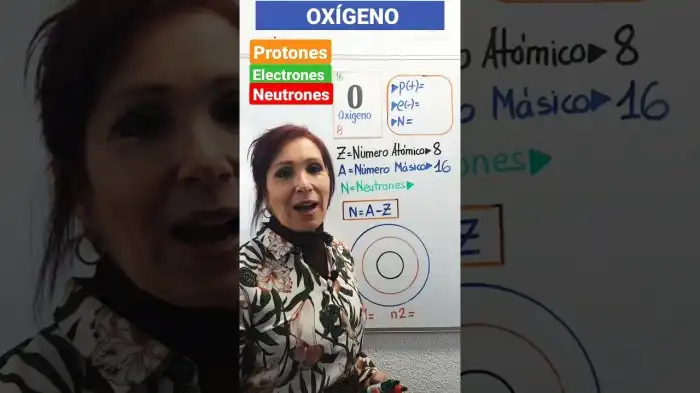
O número atômico do oxigênio (Z = 8) define sua identidade como elemento. Representado pelo símbolo O, esse número corresponde ao número de prótons em seu núcleo. Consequentemente, em um átomo neutro de oxigênio, o número de elétrons também é 8. Esta característica fundamental influencia diretamente suas propriedades químicas e sua capacidade de formar ligações.
Importância do Oxigênio na Tabela Periódica
O oxigênio desempenha um papel crucial na tabela periódica, indo além de sua simples abundância. Seu número atômico e suas propriedades químicas únicas o tornam essencial para a compreensão das tendências periódicas. Sua posição no Grupo 16 e no Período 2 reflete suas características, como eletronegatividade e reatividade, influenciando suas ligações com outros elementos e, por consequência, suas funções em diferentes compostos.
Posição do Oxigênio na Tabela Periódica
O oxigênio encontra-se no Grupo 16 (Calcogênios) e no Período 2 da tabela periódica. Sua posição, como demonstrado no diagrama simplificado, influencia suas propriedades químicas e suas interações com elementos adjacentes. Os elementos imediatamente acima, abaixo, à esquerda e à direita do oxigênio, compartilham tendências periódicas, revelando como as propriedades dos elementos variam de forma sistemática em função de seu número atômico.
A vizinhança de elementos como o nitrogênio (à esquerda) e o flúor (à direita) revela a influência recíproca das propriedades periódicas.
Elementos Próximos ao Oxigênio na Tabela Periódica
Os elementos do Grupo 16, também conhecidos como calcogênios, compartilham características químicas e físicas semelhantes ao oxigênio. A lista a seguir demonstra a relação desses elementos com o oxigênio:
- Enxofre (S): Número atômico 16. Apresenta propriedades químicas semelhantes ao oxigênio, porém com maior tamanho atômico e menor eletronegatividade, o que influencia sua reatividade. É um elemento sólido em temperatura ambiente.
- Selênio (Se): Número atômico 34. Mantém semelhanças com o enxofre e o oxigênio, mas sua reatividade é ainda menor. É um sólido em temperatura ambiente.
- Telúrio (Te): Número atômico 52. Apresenta propriedades metálicas e é um sólido em temperatura ambiente. A reatividade é menor do que os elementos anteriores.
- Polônio (Po): Número atômico 84. É um metal radioativo, e sua reatividade e propriedades físicas são significativamente diferentes dos outros calcogênios.
Comparativo entre Oxigênio e Outros Calcogênios
A tabela a seguir apresenta um comparativo das principais características dos calcogênios:
| Característica | Oxigênio (O) | Enxofre (S) | Selênio (Se) | Telúrio (Te) | Polônio (Po) |
|---|---|---|---|---|---|
| Número Atômico | 8 | 16 | 34 | 52 | 84 |
| Estado Físico (25°C) | Gás | Sólido | Sólido | Sólido | Sólido |
| Ponto de Fusão (°C) | -218,4 | 119 | 217 | 450 | 254 |
| Ponto de Ebulição (°C) | -183 | 444,6 | 685 | 988 | 962 |
| Eletronegatividade | 3,44 | 2,58 | 2,55 | 2,1 | 2,0 |
| Propriedades Químicas | Alta reatividade, forma óxidos com a maioria dos elementos. | Menos reativo que o oxigênio, mas forma compostos semelhantes. | Menos reativo que o enxofre, mas forma compostos semelhantes. | Menos reativo que o selênio, mas forma compostos semelhantes. | Menos reativo que o telúrio, mas forma compostos semelhantes. |
Importância do Oxigênio para a Vida
O oxigênio, com sua alta eletronegatividade e capacidade de formar ligações fortes, é essencial para a vida na Terra. Sua presença na atmosfera e nos organismos vivos é crucial para a respiração celular, processo fundamental para a obtenção de energia. A posição do oxigênio na tabela periódica reflete suas propriedades químicas, essenciais para a manutenção da vida.
Estrutura Atômica do Oxigênio
O oxigênio, um elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras reações químicas. Compreender sua estrutura atômica é essencial para entender suas propriedades e comportamento. Sua configuração eletrônica influencia sua reatividade e capacidade de formar ligações químicas, permitindo que o oxigênio participe de processos essenciais, como a respiração celular.
Propriedades Atômicas do Oxigênio
A estrutura atômica do oxigênio, composta por prótons, nêutrons e elétrons, determina suas propriedades químicas. Um átomo neutro de oxigênio possui um número específico de cada partícula subatômica.
| Partícula | Número |
|---|---|
| Prótons | 8 |
| Nêutrons | 8 |
| Elétrons | 8 |
A distribuição desses elétrons em torno do núcleo segue o princípio da construção, preenchendo os orbitais atômicos em ordem crescente de energia.
Configuração Eletrônica do Oxigênio
A configuração eletrônica do oxigênio, descrita em termos de subníveis, revela a organização dos elétrons em diferentes níveis e subníveis de energia. Seguindo a regra de Hund e o princípio de exclusão de Pauli, os elétrons ocupam os orbitais disponíveis. A configuração eletrônica do oxigênio é 1s 2 2s 2 2p 4.
Comparação com a Família dos Calcogênios
O oxigênio pertence à família dos calcogênios, que compartilham propriedades químicas e estruturais semelhantes. A comparação entre o oxigênio e outros elementos da família, como enxofre, selênio, telúrio e polônio, revela padrões nas suas propriedades atômicas e químicas.
| Elemento | Número Atômico | Configuração Eletrônica | Raio Atômico (pm) | Energia de Ionização (kJ/mol) |
|---|---|---|---|---|
| Oxigênio | 8 | 1s2 2s2 2p4 | 66 | 1314 |
| Enxofre | 16 | 1s2 2s2 2p6 3s2 3p4 | 102 | 999.6 |
| Selênio | 34 | [Ar] 3d10 4s2 4p4 | 117 | 940.9 |
| Telúrio | 52 | [Kr] 4d10 5s2 5p4 | 143 | 869.3 |
| Polônio | 84 | [Xe] 4f14 5d10 6s2 6p4 | 167 | 812 |
As diferenças e semelhanças nas configurações eletrônicas, números atômicos, raios atômicos e energias de ionização entre esses elementos refletem tendências periódicas.
Propriedades Químicas do Oxigênio
A alta eletronegatividade do oxigênio, combinada com sua capacidade de formar ligações covalentes, influencia significativamente seu comportamento químico. A configuração eletrônica do oxigênio, com quatro elétrons desemparelhados no subnível 2p, o torna altamente reativo. Reações com metais e não metais, formando óxidos, exemplificam essa reatividade. A formação de ligações duplas e triplas em moléculas como o dióxido de carbono (CO 2) e o monóxido de carbono (CO) demonstram a versatilidade do oxigênio na formação de diferentes ligações químicas.
Relação entre Número Atômico e Reatividade
O número atômico do oxigênio e sua configuração eletrônica são fatores determinantes em sua capacidade de formar ligações químicas e reagir com outros elementos. A tendência do oxigênio em receber elétrons para atingir a estabilidade de octeto explica sua reatividade, formando ligações iônicas e covalentes. O ganho de elétrons resulta na formação de ânions óxido (O 2-) em compostos iônicos, como óxidos metálicos.
Importância do Oxigênio para a Vida
O oxigênio é essencial para a vida na Terra, desempenhando um papel fundamental no processo de respiração celular. A respiração celular, um processo metabólico, utiliza oxigênio para liberar energia dos nutrientes, como glicose. Esse processo fornece a energia necessária para as funções vitais dos organismos vivos. A abundância de oxigênio na atmosfera garante a sobrevivência de plantas e animais.
Propriedades Físicas do Oxigênio
O oxigênio, elemento essencial para a vida na Terra, apresenta propriedades físicas distintas que o diferenciam de outros elementos. Compreender essas propriedades é crucial para a compreensão de seu comportamento em diversas situações, desde reações químicas até aplicações industriais. Suas características físicas são influenciadas por sua estrutura atômica e posição na tabela periódica.
Estado Físico
O oxigênio, na temperatura ambiente e pressão padrão, encontra-se no estado gasoso. Este estado físico é característico da fraca interação intermolecular entre as moléculas de oxigênio, o que resulta em baixas temperaturas de fusão e ebulição.
Ponto de Fusão e Ebulição
O oxigênio possui um ponto de fusão de -218,79 °C (54,36 K) e um ponto de ebulição de -182,96 °C (90,19 K). Esses valores relativamente baixos refletem a natureza fracamente polar das ligações entre os átomos de oxigênio na molécula O 2.
Densidade
A densidade do oxigênio gasoso a 25°C e 1 atm é de aproximadamente 1,429 g/cm³. A densidade é significativamente menor que a de outros elementos, especialmente em estado sólido, devido à sua baixa massa molar e ao seu estado gasoso nas condições ambientais.
Solubilidade em Água
A solubilidade do oxigênio em água é moderada e varia com a temperatura. A solubilidade decresce à medida que a temperatura aumenta. Em 20°C, a solubilidade do oxigênio na água é aproximadamente 9 mg/L.
Características Sensoriais
O oxigênio é um gás incolor, inodoro e insípido. Essas características sensoriais são comuns em gases diatômicos não polares, como o oxigênio.
Influência do Número Atômico
O número atômico do oxigênio (Z=8) influencia significativamente suas propriedades físicas. O tamanho do átomo e a força das interações intermoleculares são diretamente afetados pela atração entre os elétrons e o núcleo. O oxigênio, ao formar ligações covalentes, demonstra um comportamento de ligação que influencia a polaridade da molécula. A ligação covalente do oxigênio é fundamental para determinar seu estado físico e interações com outras substâncias.
Comparação com Outros Calcogênios
- A tabela a seguir compara as propriedades físicas do oxigênio com as dos outros calcogênios (enxofre, selênio, telúrio e polônio):
| Elemento | Estado Físico (25°C, 1 atm) | Ponto de Fusão (°C) | Ponto de Ebulição (°C) | Densidade (g/cm³) | Solubilidade em Água (mg/L) |
|---|---|---|---|---|---|
| Oxigênio | Gasoso | -218,79 | -182,96 | 1,429 (g/cm³) | 9 (aproximadamente) |
| Enxofre | Sólido | 119 | 444,6 | 2,07 | 0,014 (aproximadamente) |
| Selênio | Sólido | 217 | 685 | 4,82 | 0,1 (aproximadamente) |
| Telúrio | Sólido | 450 | 990 | 6,24 | 0,002 (aproximadamente) |
| Polônio | Metálico | 254 | 962 | 9,32 | Insolúvel |
- Observa-se uma tendência geral de aumento no ponto de fusão, ponto de ebulição e densidade à medida que descemos na família dos calcogênios. Isso se deve ao aumento do tamanho dos átomos e da força das interações intermoleculares, que passam de forças de dispersão de London a forças dipolo-dipolo e ligações de hidrogênio.
Propriedades Físicas com Elementos Próximos
| Elemento | Estado Físico | Ponto de Fusão (°C) | Ponto de Ebulição (°C) | Densidade (g/cm³) | Solubilidade em Água (mg/L) | Número Atômico |
|---|---|---|---|---|---|---|
| Nitrogênio | Gasoso | -210 | -195,8 | 1,25 | 0,01 | 7 |
| Oxigênio | Gasoso | -218,79 | -182,96 | 1,429 | 9 | 8 |
| Flúor | Gasoso | -219,62 | -188,14 | 1,696 | 0,7 | 9 |
| Neônio | Gasoso | -248,59 | -246,07 | 0,900 | 0,0001 | 10 |
- As diferenças nas propriedades físicas entre esses elementos refletem as variações no número atômico, eletronegatividade e estrutura atômica. A eletronegatividade, a força com que um átomo atrai elétrons em uma ligação, desempenha um papel crucial. A estrutura eletrônica também afeta as forças intermoleculares, determinando o estado físico.
Condutividade Térmica e Elétrica
O oxigênio, em seu estado gasoso, é um isolante térmico e elétrico. Isso ocorre devido à sua estrutura eletrônica, onde os elétrons não estão livres para se mover, impedindo a condução de calor e eletricidade. Comparando-o com o nitrogênio e o flúor, a diferença na condutividade se deve às variações na estrutura eletrônica e nas ligações químicas.
Resumo
O oxigênio, um gás diatômico essencial, apresenta um ponto de fusão e ebulição relativamente baixos, devido às fracas interações intermoleculares. Sua densidade é baixa em comparação com outros elementos, e sua solubilidade em água é moderada, variando com a temperatura. O número atômico, a eletronegatividade e a estrutura atômica do oxigênio são fundamentais para a compreensão de suas propriedades físicas, as quais diferem de outros elementos, como o enxofre e o nitrogênio.
Propriedades Químicas do Oxigênio: Numero Atomico Do Oxigenio
O oxigênio, um elemento fundamental para a vida na Terra, demonstra uma reatividade notável em diversas condições. Sua capacidade de formar ligações químicas e participar de reações químicas complexas é crucial para inúmeros processos biológicos e químicos. Neste estudo, exploraremos as propriedades químicas do oxigênio, desde sua reatividade e valência até a formação de compostos e sua importância.
Reatividade
O oxigênio é um elemento altamente reativo, especialmente em temperaturas elevadas. Sua reatividade varia dependendo da presença de catalisadores e da concentração do próprio oxigênio. Reações de combustão, por exemplo, são caracterizadas pela rápida combinação do oxigênio com outros materiais, liberando energia na forma de calor e luz. A reatividade do oxigênio com metais também é significativa, formando óxidos.
Reações com outros não-metais, como o enxofre e o nitrogênio, também ocorrem, mas com diferentes velocidades e mecanismos.
O oxigênio, na presença de calor, reage vigorosamente com diversos materiais, como o metano, resultando em combustão. Reações com metais, como o ferro, levam à formação de óxidos, processos conhecidos como oxidação.
A concentração de oxigênio desempenha um papel crucial. Em baixas concentrações, a oxidação pode ser lenta, enquanto em altas concentrações, reações podem ser explosivas. A formação de radicais livres, intermediários reativos, também está envolvida em alguns processos de oxidação.
Valência e Estados de Oxidação
O oxigênio, na maioria dos compostos, exibe uma valência de -2. Isso se deve à sua tendência em adquirir dois elétrons para atingir a configuração eletrônica de gás nobre. No entanto, o oxigênio pode apresentar outros estados de oxidação, como +1 e +2, em compostos como os peróxidos e superóxidos, respectivamente. A variação na valência está diretamente relacionada à estrutura do composto e à natureza dos átomos aos quais o oxigênio se liga.
- A valência de -2 é o estado mais comum do oxigênio, como na água (H 2O) e no dióxido de carbono (CO 2).
- Em peróxidos, como o peróxido de hidrogênio (H 2O 2), o estado de oxidação do oxigênio é +1.
- Nos superóxidos, como o superóxido de potássio (KO 2), o estado de oxidação do oxigênio é +1/2.
Tipos de Ligações Químicas
O oxigênio forma diferentes tipos de ligações químicas, incluindo ligações covalentes e iônicas. Nas moléculas de oxigênio (O 2), a ligação é covalente, resultando na formação de uma ligação dupla. Em compostos iônicos, como óxidos metálicos, o oxigênio forma ligações iônicas com metais. A polaridade das ligações influencia as propriedades físicas e químicas dos compostos.
- A ligação covalente entre átomos de oxigênio (O 2) é uma ligação dupla, resultando em uma molécula diatômica.
- Em óxidos metálicos, como o óxido de sódio (Na 2O), a ligação é iônica, caracterizada pela transferência de elétrons.
Comparação de Reatividade
A reatividade do oxigênio varia em comparação com outros elementos. Sua eletronegatividade elevada e estrutura atômica influenciam sua capacidade de atrair elétrons e formar ligações. Comparando-o com o nitrogênio, por exemplo, o oxigênio apresenta maior reatividade devido à sua maior eletronegatividade. Metais alcalinos reagem vigorosamente com o oxigênio.
- A alta eletronegatividade do oxigênio o torna mais reativo que o nitrogênio.
- Metais alcalinos, como o sódio e o potássio, reagem espontaneamente com o oxigênio.
Compostos Principais
O oxigênio forma uma ampla variedade de compostos, incluindo óxidos, ácidos e bases. A água (H 2O) é um exemplo crucial, essencial para a vida. O dióxido de carbono (CO 2) é um produto da respiração e desempenha um papel fundamental no ciclo do carbono.
- A água (H 2O) é um composto fundamental, essencial para a vida.
- O dióxido de carbono (CO 2) é um gás importante para o ciclo do carbono.
- Óxidos ácidos, como o dióxido de enxofre (SO 2), podem causar chuva ácida.
Importância Biológica e Química
O oxigênio é essencial para a respiração celular, processo que libera energia para as atividades celulares. A fotossíntese, processo crucial para a produção de alimentos pelas plantas, envolve o oxigênio. A combustão, que libera energia por meio da reação com o oxigênio, também é um processo químico importante.
A respiração celular, um processo fundamental para a vida, requer oxigênio para a liberação de energia. A fotossíntese, por sua vez, utiliza a energia solar para produzir oxigênio e açúcares.
Isótopos do Oxigênio
Os isótopos do oxigênio são variantes do elemento químico oxigênio que possuem o mesmo número atômico (8 prótons), mas diferentes números de nêutrons em seus núcleos. Essas diferenças afetam ligeiramente as propriedades físicas e, em alguns casos, as propriedades químicas, embora o comportamento químico geral seja muito similar. A compreensão dos isótopos do oxigênio é crucial em diversas áreas, desde a geologia até a medicina nuclear.
Lista dos Isótopos Estáveis
Os isótopos estáveis do oxigênio são o oxigênio-16, o oxigênio-17 e o oxigênio-18. Estes são os únicos isótopos do oxigênio que ocorrem naturalmente em abundância significativa.
Detalhes das Propriedades dos Isótopos
- Oxigênio-16 (16O): Número atômico: 8; Número de massa: 16; Número de nêutrons: 8; Configuração eletrônica: 1s 22s 22p 4; Massa atômica relativa: 15,9949 u; Estabilidade: Estável; Abundância relativa: ~99,76%; Propriedades físicas: Ponto de ebulição: -183 °C, ponto de fusão: -218 °C. O oxigênio-16 é o isótopo mais abundante do oxigênio, representando a maior parte do oxigênio encontrado na natureza.
- Oxigênio-17 (17O): Número atômico: 8; Número de massa: 17; Número de nêutrons: 9; Configuração eletrônica: 1s 22s 22p 4; Massa atômica relativa: 16,9991 u; Estabilidade: Estável; Abundância relativa: ~0,037%; Propriedades físicas: Não há dados específicos sobre ponto de fusão e ebulição disponíveis para este isótopo.
- Oxigênio-18 (18O): Número atômico: 8; Número de massa: 18; Número de nêutrons: 10; Configuração eletrônica: 1s 22s 22p 4; Massa atômica relativa: 17,99916 u; Estabilidade: Estável; Abundância relativa: ~0,204%; Propriedades físicas: Não há dados específicos sobre ponto de fusão e ebulição disponíveis para este isótopo.
Isótopos Instáveis (Radioativos)
Além dos isótopos estáveis, existem isótopos instáveis do oxigênio. Esses isótopos, também conhecidos como radioisótopos, sofrem decaimento radioativo para se tornarem mais estáveis. A meia-vida é um fator crucial na análise de isótopos radioativos. Um isótopo instável decai em um novo isótopo com um período de tempo específico.
- Oxigênio-15 (15O): Meia-vida: 122,24 segundos; Decaimento: Positron. Este isótopo é usado em estudos de medicina nuclear.
- Oxigênio-14 (14O): Meia-vida: 70,606 segundos; Decaimento: Positron. Este isótopo é outro exemplo de isótopo instável usado em medicina nuclear.
Comparação dos Isótopos
As forças nucleares fortes e fracas atuam sobre os prótons e nêutrons, influenciando a estabilidade de cada isótopo. A abundância relativa dos isótopos reflete os processos nucleares que ocorreram durante a formação do sistema solar. A diferença no número de nêutrons influencia sutilmente as propriedades químicas, mas o comportamento geral do oxigênio permanece consistente.
Aplicações dos Isótopos
Os isótopos do oxigênio têm aplicações em várias áreas.
- Geologia: A análise da proporção de isótopos de oxigênio em amostras de gelo pode revelar informações sobre as mudanças climáticas ao longo do tempo. Isso permite a reconstrução de padrões climáticos passados.
- Medicina Nuclear: Isótopos radioativos do oxigênio, como o 15O e o 14O, são usados em estudos metabólicos, permitindo aos pesquisadores visualizar o fluxo de oxigênio no corpo.
Tabela de Abundância dos Isótopos Estáveis
A tabela abaixo apresenta a abundância relativa dos isótopos estáveis do oxigênio. Os valores são aproximados e podem variar ligeiramente dependendo da fonte.
| Isótopo | Símbolo | Número de Massa | Abundância Relativa (%) |
|---|---|---|---|
| Oxigênio-16 | 16O | 16 | 99,76 |
| Oxigênio-17 | 17O | 17 | 0,037 |
| Oxigênio-18 | 18O | 18 | 0,204 |
Fonte: Dados compilados de várias fontes de química e física.
Ocorrência do Oxigênio na Natureza
O oxigênio, elemento fundamental para a vida na Terra, é incrivelmente abundante e se manifesta em diversos estados e compostos. Sua presença molda a atmosfera, os oceanos e a crosta terrestre, desempenhando papéis cruciais em inúmeros processos químicos. Vamos mergulhar na fascinante ocorrência deste elemento essencial!O oxigênio, um gás incolor, inodoro e insípido, é o elemento mais abundante na crosta terrestre e na atmosfera.
Sua presença é vital para a respiração dos seres vivos e para uma série de processos químicos. Sua abundância e diversidade de estados são aspectos chave para entender sua importância em diferentes ambientes.
Abundância do Oxigênio
O oxigênio é o elemento mais abundante na crosta terrestre, formando cerca de 46,6% da sua massa. Essa presença maciça se deve à sua capacidade de formar ligações químicas estáveis com diversos outros elementos. Na atmosfera, o oxigênio molecular (O 2) representa aproximadamente 21% do volume. Essa proporção é crucial para a manutenção da vida aeróbica.
Estados Físicos do Oxigênio
O oxigênio pode ser encontrado em diferentes estados físicos na natureza. O oxigênio gasoso (O 2) é a forma mais comum na atmosfera, essencial para a respiração. Em temperaturas extremamente baixas, o oxigênio pode se apresentar no estado líquido, como ocorre em alguns experimentos científicos. Em temperaturas ainda mais baixas, ele pode ser encontrado no estado sólido, com propriedades físicas distintas.
Exemplos de Compostos com Oxigênio
A vasta gama de compostos que contêm oxigênio é um reflexo da sua capacidade de formar ligações químicas com inúmeros elementos. A seguir, exemplos de compostos em categorias, destacando a função do oxigênio.
- Compostos Inorgânicos: Água (H 2O), dióxido de carbono (CO 2), óxido de ferro (Fe 2O 3), sulfatos (SO 42-). A água é essencial para a vida, enquanto o dióxido de carbono é fundamental para a fotossíntese. Os óxidos metálicos são componentes importantes em minerais e processos industriais.
- Compostos Orgânicos: Açúcares (ex: glicose), proteínas, gorduras (ex: triglicerídeos). O oxigênio é fundamental para a estrutura e função dessas moléculas biológicas. A glicose, por exemplo, é uma fonte de energia crucial para os seres vivos. As proteínas são essenciais para a construção e reparação dos tecidos do corpo. As gorduras desempenham um papel importante no armazenamento de energia e na composição de membranas celulares.
Comparação da Ocorrência em Diferentes Ambientes
A presença e proporção do oxigênio variam significativamente entre diferentes ambientes. Na atmosfera, a concentração de oxigênio é relativamente constante. Nos oceanos, a quantidade de oxigênio dissolvido é afetada pela temperatura, salinidade e atividade biológica. Em solos, a presença de oxigênio é crucial para a atividade de microrganismos e para o crescimento das plantas. A disponibilidade de oxigênio em cada ambiente influencia diretamente os tipos de vida que podem prosperar em cada um.
| Ambiente | Ocorrência de Oxigênio |
|---|---|
| Atmosfera | Abundante, principalmente como O2 |
| Oceanos | Dissolvido na água, em concentrações variáveis |
| Solos | Presente em diferentes níveis, dependendo da atividade biológica |
Aplicações do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras aplicações, desde a respiração humana até processos industriais complexos. Sua capacidade de oxidar e liberar energia o torna um elemento essencial em diversos setores. Neste mergulho pelas aplicações do oxigênio, vamos desvendar sua importância e versatilidade.O oxigênio, um gás incolor, inodoro e insípido, é vital para a sobrevivência de todos os seres vivos aeróbicos.
Sua presença na atmosfera garante a respiração, um processo essencial para a obtenção de energia a partir de nutrientes. Além disso, o oxigênio é fundamental em diversos processos industriais, mostrando sua versatilidade e importância para a sociedade moderna.
Respiração: A Função Vital do Oxigênio
A respiração é o processo fundamental para a obtenção de energia pelos organismos aeróbicos. O oxigênio atmosférico é absorvido pelos pulmões, transportando-se pelo sangue até as células, onde participa de reações metabólicas que liberam energia. Essa energia é utilizada para o funcionamento do corpo, desde os movimentos até o pensamento. A falta de oxigênio leva rapidamente à perda de consciência e à morte.
Aplicações Industriais do Oxigênio
O oxigênio é um componente essencial em diversos processos industriais, devido à sua capacidade de promover reações de combustão e oxidação. Em siderurgia, o oxigênio é utilizado para converter minério de ferro em aço, aumentando a eficiência e reduzindo o consumo de energia. Também é usado em diversos outros processos químicos, como a produção de metanol e outras substâncias químicas.
Utilização do Oxigênio em Diferentes Setores
A utilização do oxigênio varia significativamente entre os setores. Na medicina, o oxigênio é vital para pacientes com dificuldades respiratórias, auxiliando no tratamento de diversas condições. Na agricultura, o oxigênio é utilizado para melhorar a qualidade do solo e o crescimento das plantas. Na indústria, o oxigênio é essencial em diversos processos, como soldagem, corte e fabricação de aço.
Comparativo das Aplicações em Diversos Setores
| Setor | Aplicações | Importância |
|---|---|---|
| Medicina | Tratamento de pacientes com dificuldades respiratórias, suporte vital em cirurgias | Essencial para a manutenção da vida |
| Indústria | Soldagem, corte de metais, produção de aço, processos químicos | Aumenta a eficiência e a produtividade |
| Agricultura | Melhora a qualidade do solo, auxilia no crescimento de plantas | Fundamental para a produção de alimentos |
| Respiração Humana | Essencial para a sobrevivência | Base da vida |
O quadro acima ilustra a ampla gama de aplicações do oxigênio em diferentes setores, demonstrando sua importância para a sociedade moderna. A versatilidade do oxigênio, aliada à sua essencialidade na vida, garante sua presença crucial em diversas áreas.
Reações Químicas do Oxigênio
O oxigênio, elemento vital para a vida na Terra, desempenha um papel fundamental em inúmeras reações químicas. Essas reações, que envolvem a transferência de elétrons, são essenciais para processos vitais, geração de energia e diversos processos industriais. Compreender essas reações é crucial para o desenvolvimento de tecnologias e para a preservação ambiental.
Reações de Combustão
A combustão é uma reação rápida de oxidação que libera calor e luz. O oxigênio atua como o agente oxidante, recebendo elétrons dos combustíveis. Essas reações são amplamente utilizadas em diversas atividades humanas, desde o cozimento até a geração de energia. A velocidade e a intensidade da combustão dependem das condições do sistema, como temperatura e presença de catalisadores.
- Combustão de Metano (CH₄): Essa reação é crucial para a geração de energia em usinas de gás natural. A equação balanceada é: CH₄ + 2O₂ → CO₂ + 2H₂O. A reação ocorre acima de 500°C, com pressão atmosférica e na presença de um catalisador como platina (Pt). A platina facilita a quebra das ligações químicas, diminuindo a energia de ativação necessária para iniciar a reação.
- Combustão de Etanol (C₂H₅OH): O etanol, usado como combustível em veículos e em processos industriais, reage com o oxigênio em uma reação de combustão. A equação balanceada é: C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O. A reação ocorre acima de 300°C, em pressão atmosférica.
Oxidação do Ferro (Fe)
O ferro, em contato com o oxigênio do ar, sofre oxidação, formando óxido de ferro (ferrugem). Essa reação, embora comum, pode causar danos significativos em estruturas de aço e outros materiais metálicos.
| Reação | Temperatura (°C) | Pressão (atm) | Catalisador | Reagentes |
|---|---|---|---|---|
| Oxidação do Ferro (Fe) | Ambiente | Atmosférica | N/A | Fe + O₂ |
A equação balanceada para a oxidação do ferro é: 4Fe + 3O₂ → 2Fe₂O₃.
Características das Reações Redox
Reações redox envolvem a transferência de elétrons entre reagentes. A oxidação representa a perda de elétrons, enquanto a redução representa o ganho de elétrons. O oxigênio, como agente oxidante, frequentemente recebe elétrons das outras substâncias.
- Estados de Oxidação: A análise dos estados de oxidação dos elementos envolvidos nas reações permite entender a transferência de elétrons. Por exemplo, na combustão de metano, o carbono no metano tem estado de oxidação -4, enquanto no dióxido de carbono tem estado de oxidação +4. O oxigênio tem estado de oxidação -2 no O₂ e +4 no CO₂.
Importância das Reações do Oxigênio na Vida Cotidiana
O oxigênio desempenha um papel crucial em diversos processos vitais e industriais.
- Respiração: O oxigênio é essencial para a respiração celular, processo que libera energia das moléculas de alimento. A equação simplificada para a respiração celular é C₆H₁₂O₆ + 6O₂ → 6CO₂ + 6H₂O + energia.
- Combustão: A combustão é fundamental em diversas aplicações, como transporte (motores de combustão interna), geração de energia (usinas termoelétricas) e cozimento.
- Processos Industriais: O oxigênio é utilizado em diversos processos industriais, como a produção de aço, a síntese de produtos químicos e a soldagem.
- Proteção Ambiental: O oxigênio desempenha um papel crucial na purificação da água e no controle da poluição atmosférica, através de processos de oxidação.
Segurança com o Oxigênio
O oxigênio, essencial à vida, pode ser perigoso se não manuseado com cuidado. Compreender os riscos e as precauções de segurança é crucial para evitar acidentes e garantir a saúde e segurança de todos. A manipulação incorreta pode levar a incêndios e explosões, sendo fundamental o conhecimento das práticas seguras para lidar com esse elemento.
Riscos Associados ao Manuseio
O oxigênio puro, em altas concentrações, é um forte oxidante. Isso significa que ele reage vigorosamente com materiais combustíveis, potencializando e acelerando a combustão. A presença de impurezas, como materiais orgânicos ou partículas inflamáveis, pode criar pontos de ignição, transformando uma pequena faísca em um incêndio intenso.
Precauções de Segurança
As precauções de segurança devem ser rigorosas para evitar acidentes. É imprescindível evitar qualquer fonte de ignição, como faíscas elétricas, chamas abertas ou materiais aquecidos. A área de trabalho deve ser mantida limpa e livre de materiais combustíveis.
Equipamentos de Proteção Individual (EPI)
A utilização de EPI é fundamental para a segurança. Luvas resistentes ao calor, óculos de segurança e roupas especiais resistentes ao fogo devem ser usados por todos os profissionais envolvidos com o manuseio de oxigênio. A escolha adequada do EPI depende da tarefa e das concentrações de oxigênio envolvidas.
- Luvas resistentes ao calor: Devem ser resistentes a altas temperaturas e ao contato com o oxigênio. Um material apropriado seria o material de borracha especial para resistir ao calor e à combustão.
- Óculos de segurança: Protegem os olhos contra partículas e fragmentos que possam ser projetados em caso de incêndio ou explosão. É importante verificar se os óculos oferecem proteção contra impactos e faíscas.
- Roupas especiais: Roupas resistentes ao fogo e feitas de materiais que não se inflamam facilmente são cruciais para evitar que o corpo seja atingido por chamas. O material deve ser resistente a altas temperaturas e ao contato com o oxigênio.
Procedimentos de Emergência
Em caso de acidentes, é fundamental seguir os procedimentos de emergência. A localização e o uso correto dos extintores de incêndio devem ser conhecidos e treinados. Em caso de vazamento ou incêndio, a área deve ser isolada imediatamente e todos os envolvidos devem ser evacuados.
Métodos de Armazenamento e Transporte
Diferentes métodos de armazenamento e transporte oferecem níveis distintos de segurança. Cilindros de aço de alta pressão, equipados com válvulas e dispositivos de segurança, são comuns para o armazenamento e transporte de oxigênio em concentrações elevadas. Os recipientes devem ser armazenados em áreas bem ventiladas, longe de fontes de calor e materiais combustíveis.
| Método | Vantagens | Desvantagens |
|---|---|---|
| Cilindros de aço | Alta capacidade de armazenamento, segurança robusta com válvulas e dispositivos de segurança. | Podem ser pesados e ocupar espaço considerável. |
| Sistemas de tubulações | Flexibilidade para distribuição em grandes áreas, transporte contínuo. | Exige maior infraestrutura, maior risco de vazamentos em caso de falha nos sistemas de segurança. |
História do Número Atômico do Oxigênio
Source: tabelaperiodica.org
A jornada para compreender o oxigênio, um elemento fundamental para a vida na Terra, foi um fascinante percurso científico. Desde a observação de suas propriedades até a compreensão de sua posição na tabela periódica, a história do oxigênio reflete a evolução do pensamento científico e a colaboração de mentes brilhantes ao longo dos séculos. A descoberta e o entendimento do seu número atômico, 8, revelam a importância da investigação e da perseverança na busca do conhecimento.O conhecimento sobre o oxigênio evoluiu ao longo do tempo, passando de observações qualitativas a modelos quantitativos que descrevem sua estrutura e comportamento.
A compreensão de sua natureza elementar e de suas interações químicas com outros elementos foi crucial para avançar em áreas como a medicina, a indústria e a própria compreensão do universo.
Descoberta do Oxigênio
A descoberta do oxigênio não foi obra de um único cientista, mas sim o resultado de uma série de observações e experimentos ao longo de décadas. Diversos pesquisadores contribuíram para a compreensão de suas propriedades e importância. A busca por desvendar suas características foi impulsionada por uma combinação de curiosidade científica e o desejo de avançar no conhecimento sobre o mundo ao redor.
Evolução do Conhecimento sobre o Oxigênio
Inicialmente, a natureza do ar era vista de forma qualitativa, sem a compreensão de seus componentes. A química do século XVII e XVIII passou por uma transformação, com a introdução de métodos experimentais mais rigorosos. A separação e identificação dos gases, incluindo o oxigênio, foi crucial para avançar na compreensão das reações químicas. A ideia de que o ar não era uma substância simples, mas uma mistura de gases, começou a tomar forma.
Contribuições de Cientistas Importantes
Diversos cientistas contribuíram para o entendimento do oxigênio. Joseph Priestley, em 1774, isolou o oxigênio através da decomposição de óxido de mercúrio. Carl Wilhelm Scheele, também independentemente, realizou experimentos semelhantes. Antoine Lavoisier, ao contrário de seus predecessores, demonstrou a importância do oxigênio nas reações de combustão e respiração, revendo as teorias existentes e propondo um modelo mais completo.
As descobertas de Lavoisier foram fundamentais para o estabelecimento da química moderna.
Linha do Tempo da Descoberta do Oxigênio
- Século XVI: Inicia-se a observação dos fenômenos de combustão, sem a compreensão dos gases envolvidos.
- 1774: Joseph Priestley isola o oxigênio, mas não o identifica como elemento distinto.
- 1774: Carl Wilhelm Scheele também isola o oxigênio, porém suas descobertas não foram imediatamente publicadas.
- 1777-1780: Antoine Lavoisier demonstra o papel fundamental do oxigênio na combustão e na respiração, estabelecendo seu papel como elemento essencial.
- Século XIX: A compreensão da composição do ar e do papel do oxigênio na vida animal e vegetal torna-se mais completa.
A linha do tempo ilustra a sequência cronológica dos eventos que levaram à descoberta e à compreensão do oxigênio. A colaboração entre cientistas, a repetição de experimentos e a publicação de resultados foram cruciais para o progresso da ciência.
Comparação entre Teorias Antigas e Modernas sobre o Oxigênio
As teorias antigas sobre a composição do ar eram essencialmente qualitativas e não compreendiam a existência de elementos distintos como o oxigênio. A visão moderna, baseada em experimentos e observações quantitativas, permite descrever a estrutura atômica do oxigênio e suas interações químicas, incluindo a formação de compostos e reações. A química moderna, com sua abordagem quantitativa, permitiu uma compreensão profunda das propriedades e do comportamento do oxigênio.
“A descoberta do oxigênio marcou um ponto de inflexão na história da química, ao revelar a importância de um elemento essencial para a vida e as reações químicas.”
Relação entre Número Atômico e Massa Atômica do Oxigênio

Source: com.br
O número atômico e a massa atômica são conceitos fundamentais na química e na física. Compreender sua relação é essencial para descrever e prever o comportamento dos elementos, incluindo o oxigênio. A seguir, exploraremos essa relação, com foco no oxigênio, incluindo as unidades de medida, cálculos e comparação com outros elementos.A massa atômica de um elemento reflete a massa total de prótons e nêutrons em seu núcleo.
O número atômico, por sua vez, indica o número de prótons no núcleo. A relação entre esses dois valores é crucial para entender as propriedades dos elementos.
Definição do Número Atômico
O número atômico (Z) de um elemento representa o número de prótons presentes em seu núcleo. Para o oxigênio, o número atômico é 8. Isso significa que cada átomo de oxigênio possui 8 prótons.
Definição da Massa Atômica
A massa atômica (A) de um elemento representa a massa total de prótons e nêutrons em seu núcleo. Para o oxigênio, a massa atômica é aproximadamente 16 u (unidades de massa atômica). É importante ressaltar que esta massa é uma média ponderada dos isótopos do oxigênio.
Unidade de Medida: Unidade de Massa Atômica (u)
A unidade de massa atômica (u) é uma unidade de medida padrão para a massa das partículas atômicas. Ela é definida como 1/12 da massa de um átomo de carbono-12. Essa unidade é utilizada para expressar as massas atômicas dos elementos de forma consistente e comparável.
Cálculos Envolvidos
A massa atômica é geralmente calculada como a soma do número de prótons e nêutrons no núcleo. O número de nêutrons pode variar entre os diferentes isótopos de um mesmo elemento. No caso do oxigênio, a maioria dos átomos tem 8 nêutrons, resultando em uma massa atômica média próxima de 16 u. Para calcular a massa atômica precisa, é preciso considerar a abundância relativa de cada isótopo do oxigênio.
Comparação com Outros Elementos
A massa atômica do oxigênio (aproximadamente 16 u) varia em relação a outros elementos. O hidrogênio, por exemplo, tem massa atômica aproximadamente 1 u, enquanto o ferro tem massa atômica aproximadamente 56 u. A diferença na massa atômica reflete as diferentes quantidades de prótons e nêutrons nos núcleos dos átomos.
Influência do Número Atômico na Massa Atômica
O número atômico influencia diretamente a massa atômica porque determina o número de prótons. Como a massa de um próton é relativamente constante, um aumento no número atômico geralmente resulta em um aumento na massa atômica. No entanto, é importante considerar a presença de nêutrons, que também contribuem para a massa atômica, e a variação na abundância de isótopos.
Por exemplo, o número atômico do carbono é 6, e sua massa atômica é aproximadamente 12 u. O nitrogênio, com número atômico 7, tem massa atômica aproximadamente 14 u.
Aplicações do Conhecimento do Número Atômico do Oxigênio em Outros Campos
O número atômico do oxigênio, 8, é uma chave fundamental para compreender suas propriedades e seu comportamento em diversas reações químicas. Este conhecimento, aparentemente simples, tem implicações surpreendentes em campos tão distintos quanto a medicina, a engenharia e a geologia. Compreender como o oxigênio interage com outros elementos e compostos é crucial para avanços científicos e tecnológicos.O conhecimento do número atômico do oxigênio, 8, permite a previsão de seu comportamento químico e sua interação com outros elementos.
Essa capacidade de previsão é vital para aplicações em áreas diversas, permitindo a criação de modelos e a compreensão de processos complexos. O impacto do conhecimento do número atômico do oxigênio vai além da química pura, alcançando aplicações práticas em áreas como medicina, engenharia e geologia.
Aplicações em Medicina, Numero Atomico Do Oxigenio
O oxigênio desempenha um papel vital no metabolismo humano. Sua capacidade de reagir com outros elementos, como o carbono e o hidrogênio, liberando energia, é fundamental para a respiração celular. A compreensão das propriedades do oxigênio é essencial para o desenvolvimento de equipamentos médicos, como respiradores artificiais, que garantem o suprimento adequado de oxigênio para pacientes com problemas respiratórios.
O número atômico do oxigênio, por sua vez, ajuda a entender como o oxigênio se combina com outros elementos para formar moléculas, o que tem aplicações importantes em pesquisas sobre a bioquímica do corpo.
Aplicações em Engenharia
No campo da engenharia, o oxigênio é crucial em processos como a combustão. A queima eficiente de combustíveis, seja em motores de carros ou em usinas termoelétricas, depende da presença de oxigênio na reação. O conhecimento das propriedades do oxigênio permite a otimização dos processos, aumentando a eficiência e a segurança. Além disso, o oxigênio é um componente essencial em vários processos industriais, como a produção de aço, o que exige um controle preciso das reações químicas envolvendo o oxigênio.
Aplicações em Geologia
Na geologia, o oxigênio é um elemento-chave na formação de rochas e minerais. Sua presença ou ausência em diferentes ambientes geológicos pode indicar a presença de água ou outros compostos. O número atômico do oxigênio permite a identificação de minerais, a interpretação de dados geológicos e a compreensão da evolução da Terra. A análise da composição isotópica do oxigênio em amostras rochosas pode revelar informações valiosas sobre a temperatura e pressão em que as rochas foram formadas.
Previsão de Propriedades
O número atômico do oxigênio, 8, influencia diretamente as propriedades químicas e físicas do elemento. Essa relação permite prever, por exemplo, a reatividade do oxigênio com outros elementos, a sua capacidade de formar ligações químicas e suas características físicas, como ponto de fusão e ebulição. A compreensão dessas propriedades é crucial para o desenvolvimento de novas tecnologias e a aplicação do oxigênio em diversas áreas.
Impacto em Diferentes Campos
O conhecimento do número atômico do oxigênio tem um impacto significativo em diversos campos científicos e tecnológicos. Na medicina, permite o desenvolvimento de tratamentos mais eficazes e a criação de equipamentos que garantem o suprimento adequado de oxigênio. Em engenharia, otimiza processos industriais, garantindo a eficiência e segurança. Em geologia, permite a interpretação de dados geológicos e a compreensão da evolução da Terra.
O impacto é evidente em todas as áreas, demonstrando a importância da compreensão fundamental das propriedades dos elementos químicos.
Comparação do Número Atômico do Oxigênio com Outros Elementos
O número atômico do oxigênio, 8, é um valor fundamental que define suas propriedades e comportamento químico. Comparar o número atômico do oxigênio com outros elementos da tabela periódica nos permite entender padrões e tendências importantes, revelando como pequenas diferenças podem resultar em comportamentos químicos distintos. Analisar essas comparações nos permite prever e entender melhor o comportamento de outros elementos.
Comparação na Tabela Periódica
O oxigênio, localizado no grupo 16 e no período 2 da tabela periódica, apresenta características únicas em comparação com outros elementos. Sua posição na tabela revela tendências periódicas em eletronegatividade, raio atômico e energia de ionização. Elementos próximos, como o enxofre (S) e o selênio (Se), exibem similaridades, mas também diferenças significativas em suas propriedades. Comparar o oxigênio com elementos do mesmo grupo, como o enxofre, permite observar como a variação de camadas eletrônicas e o aumento da massa atômica afetam o comportamento químico.
Propriedades e Comportamento Químico
O número atômico influencia diretamente as propriedades químicas do oxigênio. Sua alta eletronegatividade, característica de seu número atômico, impulsiona sua capacidade de formar ligações covalentes polares e participar de reações de oxidação. Essa capacidade de ganhar elétrons o torna um agente oxidante poderoso, o que difere, por exemplo, do comportamento do nitrogênio (N), que, embora também seja um não-metal, apresenta propriedades oxidantes muito mais fracas.
Essa diferença na eletronegatividade e no número de elétrons na camada de valência explica as diferenças no comportamento químico entre o oxigênio e outros elementos.
Ligações Químicas e Número Atômico
A estrutura eletrônica do oxigênio, determinada por seu número atômico, afeta diretamente as ligações químicas que ele pode formar. A necessidade de dois elétrons adicionais para completar sua camada de valência, o leva a formar ligações covalentes fortes com outros elementos, como o hidrogênio (H) para formar água (H 2O), um composto essencial para a vida. Essa formação de ligações está intrinsecamente relacionada ao número atômico, e as diferenças no número atômico levam a diferentes tipos de ligações e a diferentes propriedades físicas e químicas entre os elementos.
Quadro Comparativo
| Elemento | Número Atômico | Eletronegatividade | Estado Físico (à temperatura ambiente) | Comportamento Químico |
|---|---|---|---|---|
| Oxigênio (O) | 8 | 3,44 | Gás | Agente oxidante forte, forma ligações covalentes polares |
| Enxofre (S) | 16 | 2,58 | Sólido | Agente oxidante menos forte que o oxigênio, forma ligações covalentes |
| Nitrogênio (N) | 7 | 3,04 | Gás | Menos reativo que o oxigênio, forma ligações covalentes |
Contribuição para o Entendimento Geral dos Elementos
A comparação do número atômico do oxigênio com outros elementos demonstra como as propriedades químicas dos elementos estão intrinsecamente ligadas à sua estrutura atômica. Compreender essas relações nos permite prever o comportamento de novos elementos e entender a diversidade da tabela periódica. A análise dessas tendências é fundamental para o desenvolvimento de novos materiais e para o entendimento dos processos químicos em sistemas complexos.
Concluímos nossa jornada pelo Número Atômico do Oxigênio, explorando sua importância vital para a vida e seu lugar na tabela periódica. Esperamos que você tenha desvendado os mistérios desse elemento fundamental e compreendido sua influência em diversas áreas do conhecimento. O oxigênio, com seu número atômico 8, é muito mais que um simples elemento; ele é um pilar da vida como a conhecemos!
Qual a importância do oxigênio na respiração celular?
O oxigênio é essencial na respiração celular, pois atua como o aceptor final de elétrons na cadeia respiratória, permitindo a produção de ATP, a principal moeda energética das células.
Como o número atômico do oxigênio influencia suas propriedades químicas?
O número atômico (8) determina o número de prótons e elétrons do oxigênio, o que, por sua vez, influencia sua eletronegatividade e sua capacidade de formar ligações químicas, tornando-o altamente reativo.
Quais são os estados físicos do oxigênio à temperatura ambiente?
À temperatura ambiente, o oxigênio existe como um gás.
Qual a diferença entre isótopos estáveis e instáveis de oxigênio?
Isótopos estáveis possuem uma combinação de prótons e nêutrons que os mantém estáveis ao longo do tempo, enquanto isótopos instáveis, ou radioativos, sofrem decaimento nuclear para se tornarem estáveis.





