Qual É O Número Atômico Do Oxigênio? Prepare-se para uma aventura fascinante pelo mundo da química! Vamos desvendar o mistério por trás desse número crucial que define o oxigênio, um elemento fundamental para a vida na Terra. Desvendemos sua posição na tabela periódica, sua estrutura atômica e as propriedades que o tornam tão especial. Prepare-se para aprender coisas incríveis sobre este elemento essencial!
O oxigênio, com seu número atômico, desempenha um papel vital em inúmeros processos biológicos e químicos. A compreensão desse número é fundamental para entender sua reatividade, suas ligações com outros elementos e sua importância para a vida na Terra. Acompanhe-nos nessa jornada emocionante!
O Número Atômico do Oxigênio
Source: conceitos.com
O número atômico é uma propriedade fundamental que define os elementos químicos. Ele revela informações cruciais sobre a estrutura atômica, permitindo a identificação única de cada elemento na tabela periódica. Compreender o número atômico do oxigênio, assim como sua posição e características, é essencial para entender suas propriedades e reações químicas.
Definição do Número Atômico
O número atômico de um elemento químico corresponde ao número de prótons presentes no núcleo de seu átomo. Cada elemento possui um número atômico único, que o distingue de todos os outros elementos. Por exemplo, o número atômico do oxigênio é 8, significando que cada átomo de oxigênio possui 8 prótons em seu núcleo.
Importância do Número Atômico na Identificação dos Elementos
O número atômico desempenha um papel crucial na identificação única dos elementos. Elementos diferentes possuem diferentes números atômico, permitindo sua clara distinção. Essa propriedade fundamental permite a organização sistemática dos elementos na tabela periódica, facilitando a compreensão de suas propriedades e comportamentos.
Posição do Oxigênio na Tabela Periódica
O oxigênio, representado pelo símbolo O, está localizado no grupo 16 (antigo grupo VI A) e no período 2 da tabela periódica. Sua posição na tabela periódica reflete suas propriedades químicas e físicas, como sua reatividade e capacidade de formar ligações. A posição do elemento na tabela fornece informações valiosas sobre sua eletronegatividade, energia de ionização e afinidade eletrônica.
Dados do Oxigênio e Outros Elementos
| Elemento | Símbolo | Número Atômico | Grupo | Período |
|---|---|---|---|---|
| Oxigênio | O | 8 | 16 | 2 |
| Hidrogênio | H | 1 | 1 | 1 |
| Carbono | C | 6 | 14 | 2 |
| Nitrogênio | N | 7 | 15 | 2 |
| Hélio | He | 2 | 18 | 1 |
Propriedades do Oxigênio
O oxigênio é um elemento essencial para a vida na Terra. Sua natureza altamente reativa, devido ao seu número atômico e estrutura eletrônica, permite que ele forme ligações covalentes com diversos outros elementos, formando moléculas essenciais para a respiração e outras funções biológicas. O oxigênio é um gás diatômico (O 2) em temperatura ambiente e apresenta propriedades físicas como ponto de fusão e ebulição específicos, relacionados às suas interações intermoleculares.
Importância do Número Atômico na Classificação dos Elementos
O número atômico é a chave para a organização sistemática dos elementos químicos na tabela periódica. Cada elemento é único, e seu número atômico, que reflete o número de prótons em seu núcleo, é a característica que permite a classificação e a predição de suas propriedades. O oxigênio, com seu número atômico 8, ocupa uma posição específica na tabela, o que permite prever seu comportamento químico e físico.
Sua reatividade, por exemplo, está intrinsecamente ligada ao seu número atômico e à sua estrutura eletrônica. A tabela periódica, baseada nos números atômicos, é uma ferramenta fundamental para cientistas e estudantes de química, permitindo a previsão e compreensão das propriedades dos elementos e suas interações.
Estrutura Atômica do Oxigênio
O oxigênio, um elemento fundamental para a vida na Terra, possui uma estrutura atômica que influencia suas propriedades químicas e reações. Compreender sua composição, distribuição eletrônica e comparação com outros elementos é crucial para a compreensão de sua importância em diversos processos biológicos e químicos.
Composição Atômica
O átomo de oxigênio, representado pelo símbolo O, possui um núcleo contendo prótons e nêutrons, e uma nuvem eletrônica circundando esse núcleo. A compreensão da quantidade e distribuição desses componentes é essencial para descrever a estrutura atômica do oxigênio.
- Prótons: O oxigênio possui 8 prótons em seu núcleo.
- Nêutrons: O número de nêutrons pode variar, resultando em isótopos diferentes. O isótopo mais comum do oxigênio, 16O, possui 8 nêutrons. Outros isótopos, como o 17O e o 18O, possuem 9 e 10 nêutrons, respectivamente. A abundância relativa desses isótopos influencia as propriedades médias do oxigênio.
- Elétrons: O oxigênio possui 8 elétrons. A distribuição eletrônica desses elétrons em camadas e subníveis determina o comportamento químico do elemento. A distribuição eletrônica em camadas eletrônicas segue o princípio da mínima energia.
Distribuição Eletrônica Detalhada
A distribuição eletrônica do oxigênio, seguindo o princípio de Aufbau e a regra de Hund, mostra a organização dos elétrons nos diferentes níveis e subníveis de energia. Esta organização é crucial para prever as propriedades químicas do elemento.
- Configuração Eletrônica: A configuração eletrônica completa do oxigênio é 1s 2 2s 2 2p 4. Isso significa que o primeiro nível de energia (n=1) possui dois elétrons no subnível s, enquanto o segundo nível (n=2) possui dois elétrons no subnível s e quatro elétrons no subnível p.
- Diagrama de Linus Pauling: O diagrama de Linus Pauling ilustra a distribuição dos elétrons nos orbitais atômicos. Cada caixa representa um orbital e as setas representam os elétrons, obedecendo o princípio da exclusão de Pauli e a regra de Hund. Este diagrama auxilia na visualização da organização espacial dos elétrons.
- Representação Gráfica: A representação gráfica da estrutura atômica do oxigênio mostra os níveis de energia (camadas eletrônicas) e os subníveis (s, p, d, f) dentro de cada camada. Cada nível e subnível possui um número máximo de elétrons que podem ser acomodados. A disposição dos elétrons nos orbitais representa a configuração eletrônica do oxigênio.
Comparação com Outros Elementos
Comparar a estrutura atômica do oxigênio com outros elementos, especialmente aqueles de sua família e com massas atômicas próximas, permite observar padrões e tendências nas propriedades periódicas. A estrutura atômica influencia as propriedades químicas dos elementos.
- Elementos da Família do Oxigênio: O oxigênio pertence à família dos calcogênios (grupo 16 da tabela periódica). Elementos como o enxofre (S) e o selênio (Se) também pertencem a essa família. Comparando a estrutura eletrônica do oxigênio com esses elementos, podemos observar semelhanças e diferenças em suas propriedades químicas. Por exemplo, o aumento do número de camadas eletrônicas influencia a reatividade e as propriedades físicas.
- Elementos de Massa Atômica Próxima: Elementos com massas atômicas próximas ao oxigênio, como o nitrogênio (N) e o flúor (F), apresentam estruturas atômicas que influenciam suas propriedades químicas. A adição de prótons e nêutrons afeta a massa atômica e a estrutura do núcleo, o que impacta as propriedades químicas e físicas.
| Elemento | Número Atômico | Número de Prótons | Número de Nêutrons (16O) | Configuração Eletrônica |
|---|---|---|---|---|
| Oxigênio (O) | 8 | 8 | 8 | 1s2 2s2 2p4 |
| Enxofre (S) | 16 | 16 | 16 | 1s2 2s2 2p6 3s2 3p4 |
| Selênio (Se) | 34 | 34 | 40 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 |
A tabela acima ilustra uma comparação entre o oxigênio e dois elementos de sua família, mostrando as diferenças em número atômico, número de prótons, nêutrons e configuração eletrônica. A análise destas diferenças demonstra as tendências periódicas na tabela periódica.
Propriedades do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, apresenta uma série de propriedades físicas e químicas que o distinguem de outros elementos. Compreender essas características é crucial para diversas aplicações, desde a respiração até a combustão e a produção de energia. Vamos mergulhar nas propriedades fascinantes deste elemento vital!
Propriedades Físicas do Oxigênio
O oxigênio, na sua forma mais comum, é um gás incolor, inodoro e insípido. Sua existência em diferentes estados físicos, dependendo da temperatura e pressão, reflete a sua natureza molecular e as interações entre as moléculas.
- Estado Físico: A temperatura ambiente e pressão atmosférica padrão, o oxigênio é um gás. Em condições de extrema baixa temperatura, ele pode se transformar em líquido e, posteriormente, em sólido, com estruturas cristalinas específicas. Isso demonstra a flexibilidade das moléculas de oxigênio em se adaptar a diferentes ambientes.
- Ponto de Fusão: O oxigênio funde a uma temperatura extremamente baixa, -218,4 °C. Esta característica baixa indica fracas forças intermoleculares, resultando em uma fácil transição para o estado líquido.
- Ponto de Ebulição: O ponto de ebulição do oxigênio, -182,96 °C, é ligeiramente superior ao seu ponto de fusão. Este valor, novamente, demonstra a relativa fraqueza das interações intermoleculares entre as moléculas de oxigênio.
- Densidade: A densidade do oxigênio gasoso é menor que a da água, sendo de aproximadamente 1,429 gramas por litro. A baixa densidade contribui para a capacidade do oxigênio de se difundir no ar e estar disponível para os processos vitais.
Propriedades Químicas do Oxigênio
As propriedades químicas do oxigênio refletem sua alta reatividade e capacidade de formar ligações químicas com uma variedade de elementos.
- Reatividade: O oxigênio é um elemento altamente reativo, formando óxidos com a maioria dos elementos. Essa reatividade é fundamental para processos como a respiração, combustão e a formação de compostos orgânicos.
- Afinidade Eletrônica: A afinidade eletrônica do oxigênio é alta, indicando sua tendência a ganhar elétrons para completar sua camada de valência. Esta característica contribui para a formação de ligações covalentes e iônicas em uma variedade de compostos.
- Eletronegatividade: O oxigênio é um elemento muito eletronegativo, o que significa que ele atrai elétrons fortemente em uma ligação química. Sua alta eletronegatividade é crucial para a formação de ligações covalentes polares e para a estabilidade dos compostos orgânicos.
Comparação com Outros Elementos Não Metálicos
Comparando o oxigênio com outros elementos não metálicos, podemos observar semelhanças e diferenças em suas propriedades.
- Comparação: O oxigênio, como outros não metais, tende a formar ligações covalentes. No entanto, a sua alta eletronegatividade e reatividade o distinguem de elementos menos reativos, como o nitrogênio, por exemplo. A diversidade de compostos formados pelo oxigênio demonstra sua versatilidade química.
Tabela de Propriedades do Oxigênio
| Propriedade | Valor | Unidade | Descrição |
|---|---|---|---|
| Estado Físico | Gás | – | A temperatura ambiente e pressão atmosférica padrão. |
| Ponto de Fusão | -218,4 | °C | Temperatura na qual o oxigênio se transforma em sólido. |
| Ponto de Ebulição | -182,96 | °C | Temperatura na qual o oxigênio se transforma em gás. |
| Densidade | 1,429 | g/L | Densidade do oxigênio gasoso a 0°C e 1 atm. |
Aplicações do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras aplicações, desde processos industriais até as funções vitais de nossos organismos. Sua capacidade de sustentar a combustão e a respiração o torna essencial para o funcionamento de diversos sistemas. Vamos explorar as aplicações mais notáveis deste elemento tão vital.
Aplicações na Indústria
O oxigênio é amplamente utilizado em processos industriais, impulsionando a eficiência e a produtividade em diversas áreas. Sua alta reatividade o torna um agente poderoso em reações químicas. A utilização de oxigênio puro em fornos, por exemplo, permite a obtenção de temperaturas mais elevadas e a combustão mais eficiente de materiais, otimizando a produção em indústrias como a siderúrgica e a metalúrgica.
| Aplicação | Descrição | Benefícios | Exemplo |
|---|---|---|---|
| Soldagem | O oxigênio, em conjunto com o acetileno, é utilizado na soldagem de metais. A combustão controlada permite altas temperaturas, possibilitando a união de peças metálicas. | Alta eficiência, precisão e qualidade na união de materiais. | Soldagem de tubulações em refinarias de petróleo. |
| Corte de metais | Utilizando o oxigênio em conjunto com outros gases, é possível cortar metais de forma precisa e controlada, o que simplifica tarefas em diversos setores. | Precisão, controle e eficiência no corte de metais. | Corte de chapas de aço em construções. |
| Produção de aço | O oxigênio é fundamental na produção de aço, atuando como agente oxidante, que remove impurezas e ajusta a composição do metal. | Aumento da pureza e controle da composição do aço, melhorando sua qualidade. | Produção de aço em usinas siderúrgicas. |
| Combustão | O oxigênio é o elemento essencial para a combustão. Em diversas indústrias, o oxigênio puro é utilizado para otimizar o processo de combustão em fornos e caldeiras. | Aumento da eficiência energética, controle da combustão e maior rendimento. | Combustão em fornos de cerâmica. |
Aplicações na Vida Cotidiana
A presença do oxigênio na vida cotidiana é fundamental, permeando desde processos de respiração até a própria combustão que permite o funcionamento de diversos aparelhos.
Respiração
A respiração é o processo pelo qual o oxigênio é absorvido pelo corpo e utilizado para liberar energia dos alimentos. Sem oxigênio, o corpo humano não pode realizar as funções metabólicas essenciais.
O oxigênio é essencial para a respiração celular, um processo vital para a obtenção de energia.
Combustão
A combustão, a reação química de um combustível com o oxigênio, liberando calor e luz, é fundamental em inúmeras atividades do nosso cotidiano. Desde a queima de madeira em uma fogueira até o funcionamento de motores a combustão interna, o oxigênio é o elemento fundamental para a reação.
Ocorrência do Oxigênio na Natureza
O oxigênio é um elemento fundamental para a vida na Terra, desempenhando papéis cruciais em diversos ecossistemas. Sua presença na atmosfera, na água e na crosta terrestre é vital para a manutenção da vida como a conhecemos. Neste tópico, exploraremos detalhadamente a ocorrência desse elemento em diferentes ambientes, destacando sua importância e as interações com outros componentes.
Ocorrência do Oxigênio na Atmosfera
O oxigênio é um componente essencial da atmosfera terrestre. Sua presença é fundamental para a respiração de muitos organismos vivos.
- Proporção Percentual: O oxigênio representa aproximadamente 21% da composição da atmosfera terrestre. Essa porcentagem é crucial para a manutenção da vida aeróbica.
- Camadas Atmosféricas: O oxigênio está presente em todas as camadas da atmosfera, mas sua concentração varia. Na troposfera, a camada mais próxima da superfície, a concentração de oxigênio é mais alta, fundamental para a vida terrestre. A concentração diminui nas camadas superiores, como a estratosfera.
- Origem do Oxigênio Atmosférico: A fotossíntese é o principal processo responsável pela produção de oxigênio atmosférico. Organismos fotossintetizantes, como plantas, algas e cianobactérias, utilizam a energia solar para converter dióxido de carbono e água em açúcares, liberando oxigênio como subproduto. Esse processo ao longo de bilhões de anos, contribuiu para a composição atual da atmosfera.
- Importância para a Vida: O oxigênio é essencial para a respiração aeróbica, um processo metabólico fundamental para a maioria dos organismos terrestres. A energia necessária para as funções vitais é extraída através da oxidação de moléculas orgânicas utilizando o oxigênio.
Ocorrência do Oxigênio na Água
A água também contém oxigênio, crucial para a vida aquática.
- Formas do Oxigênio na Água: O oxigênio na água se encontra na forma de oxigênio molecular (O 2), dissolvido. A quantidade de oxigênio dissolvido na água depende de vários fatores, incluindo a temperatura e a salinidade.
- Importância para a Vida Aquática: Organismos aquáticos, como peixes e outros animais, necessitam de oxigênio dissolvido na água para a respiração. A disponibilidade de oxigênio é um fator crítico para a saúde dos ecossistemas aquáticos.
- Concentração de Oxigênio e Vida Aquática: A concentração de oxigênio dissolvido afeta diretamente a biodiversidade e a saúde dos ecossistemas aquáticos. Baixos níveis de oxigênio podem levar à mortandade de peixes e outros organismos aquáticos.
- Fatores Ambientais: A temperatura, a pressão e a poluição afetam a solubilidade do oxigênio na água. Águas mais quentes geralmente têm menor capacidade de dissolver oxigênio. A poluição pode reduzir a quantidade de oxigênio disponível, prejudicando os organismos aquáticos.
Comparação da Abundância do Oxigênio
A abundância do oxigênio varia em diferentes meios.
| Elemento | Porcentagem na Crosta Terrestre |
|---|---|
| Oxigênio | 46,6% |
| Silício | 27,7% |
| Alumínio | 8,1% |
| Ferro | 5,0% |
| Cálcio | 3,6% |
A tabela acima demonstra a abundância dos cinco elementos mais presentes na crosta terrestre. O oxigênio é o elemento mais abundante. A abundância em outros meios, como a atmosfera e a água, varia.
Diagrama da Composição Atmosférica
Este diagrama representa a composição da atmosfera terrestre, destacando a presença do oxigênio.
O diagrama utilizará cores distintas para cada gás, incluindo nitrogênio, oxigênio, argônio, dióxido de carbono e outros gases traço. O oxigênio será destacado em uma cor vibrante, permitindo uma fácil identificação. A escala vertical representará a altitude, e a escala horizontal, a porcentagem de cada gás na atmosfera. O diagrama será responsivo, adaptando-se a diferentes tamanhos de tela. As legendas serão claras e concisas para facilitar a compreensão.
Importância do Oxigênio para a Vida na Terra
O oxigênio desempenha um papel fundamental na manutenção da vida na Terra, sustentando ecossistemas complexos. É essencial para a respiração aeróbica, processo que libera energia dos alimentos, impulsionando as atividades de todos os seres vivos que dependem do ar. Nas florestas tropicais, o oxigênio é vital para a respiração das árvores e animais. Nos oceanos, o oxigênio dissolvido sustenta a vida de peixes e outros organismos marinhos.
A presença de oxigênio nas rochas e minerais da crosta terrestre também afeta os processos geológicos. A interação entre o oxigênio e outros elementos, como o carbono, é crucial para o ciclo da matéria na Terra. Sem o oxigênio, a vida na Terra como a conhecemos não existiria.
Ligações Químicas do Oxigênio
O oxigênio, elemento fundamental para a vida, forma uma variedade de ligações químicas, principalmente covalentes, que definem suas propriedades e participação em inúmeros compostos essenciais. A compreensão dessas ligações é crucial para entender sua importância em processos biológicos e industriais. A eletronegatividade elevada do oxigênio desempenha um papel determinante na natureza das ligações que forma.As ligações químicas do oxigênio, sobretudo covalentes, são caracterizadas pela compartilhamento de elétrons entre átomos.
Essa característica o diferencia de outros elementos, como os metais, que tendem a perder elétrons em ligações iônicas. A capacidade de formar ligações covalentes é essencial para a formação de moléculas complexas, como a água e o dióxido de carbono.
Tipos de Ligações
O oxigênio apresenta uma forte tendência a formar ligações covalentes, compartilhando elétrons com outros átomos. Essa característica é resultado de sua alta eletronegatividade, que o torna um elemento muito capaz de atrair elétrons. Em contraste, as ligações iônicas, embora presentes em alguns compostos de oxigênio, são menos frequentes que as covalentes. As ligações covalentes, em particular, podem ser polares ou apolares, dependendo da diferença de eletronegatividade entre os átomos envolvidos.
Ligações com Outros Elementos
O oxigênio forma ligações com uma ampla gama de elementos, incluindo metais e não metais. A polaridade das ligações é influenciada pela diferença de eletronegatividade entre os átomos. Em ligações com hidrogênio, como na água (H₂O), a alta eletronegatividade do oxigênio resulta em uma ligação covalente polar, onde os elétrons são atraídos mais fortemente para o oxigênio. Em compostos com carbono, como o dióxido de carbono (CO₂), a ligação covalente também é polar, mas a geometria molecular contribui para uma molécula apolar.
Ligações com outros elementos, como nitrogênio (NO), enxofre (SO₂), e outros, apresentam diferentes graus de polaridade, influenciando as propriedades físicas dos compostos formados.
Comparação com Outros Elementos
A capacidade do oxigênio de formar ligações varia em relação a outros elementos da tabela periódica. Comparando com elementos vizinhos como o enxofre e o nitrogênio, a eletronegatividade do oxigênio o diferencia. O oxigênio é mais eletronegativo que o enxofre e o nitrogênio, o que leva a ligações polares mais acentuadas quando o oxigênio está envolvido. A alta eletronegatividade do oxigênio influencia diretamente as forças intermoleculares, como as ligações de hidrogênio, que são fundamentais para as propriedades da água.
O flúor, elemento mais eletronegativo que o oxigênio, forma ligações covalentes ainda mais polares.
Formação da Água (H₂O) e Dióxido de Carbono (CO₂)
A água (H₂O) é um composto fundamental na química e na biologia. A molécula de água é formada por dois átomos de hidrogênio ligados covalentemente a um átomo de oxigênio. A alta eletronegatividade do oxigênio atrai os elétrons de ligação, resultando em uma ligação covalente polar. A geometria angular da molécula de água contribui para suas propriedades únicas, incluindo a capacidade de formar pontes de hidrogênio.O dióxido de carbono (CO₂) é outro composto importante.
A molécula de dióxido de carbono é formada por um átomo de carbono ligado covalentemente a dois átomos de oxigênio. A geometria linear da molécula resulta em uma ligação covalente polar, mas, devido à disposição simétrica dos átomos, a molécula é apolar.
Instruções para criar as imagens: As imagens acima podem ser obtidas em bancos de imagens gratuitos online, como o Wikimedia Commons. É necessário encontrar imagens que representem as estruturas de Lewis da água e do dióxido de carbono. É crucial que as imagens apresentem a disposição dos átomos e as ligações covalentes de forma clara.
Representação das Ligações
Para representar as ligações químicas, são utilizadas estruturas de Lewis. As estruturas de Lewis demonstram a disposição dos elétrons de valência em uma molécula, incluindo os elétrons compartilhados nas ligações covalentes. As ligações covalentes são representadas por traços entre os átomos, enquanto os pares de elétrons não compartilhados são representados por pontos.
Reações Químicas do Oxigênio: Qual É O Número Atômico Do Oxigênio
O oxigênio, um elemento vital para a vida na Terra, é um participante fundamental em inúmeras reações químicas. Sua alta reatividade, combinada com sua presença abundante na atmosfera, o coloca no centro de processos essenciais, desde a respiração até a combustão. Compreender essas reações é crucial para entender o funcionamento do mundo ao nosso redor.
Tipos de Reações do Oxigênio
O oxigênio demonstra uma ampla gama de comportamentos reacionais, podendo atuar como agente oxidante em diversas reações químicas. Essas reações envolvem a transferência de elétrons, resultando em mudanças nas propriedades dos reagentes. Podemos categorizar as reações do oxigênio em diferentes tipos, cada um com suas próprias características e condições específicas.
Reações de Combustão
A combustão é uma reação química rápida que libera calor e luz. O oxigênio é um reagente essencial nessas reações, combinando-se com outros elementos para formar compostos como dióxido de carbono e água. A velocidade e a intensidade da combustão dependem da quantidade de oxigênio disponível e das propriedades dos materiais envolvidos. Um exemplo clássico é a queima de madeira, onde o oxigênio reage com a celulose, liberando calor e luz.
A reação de combustão completa de metano (gás natural) produz dióxido de carbono e água.
Reações de Combustão Incompleta
Reações de combustão incompleta ocorrem quando a quantidade de oxigênio é insuficiente para oxidar completamente os reagentes. Nesses casos, além de dióxido de carbono, podem ser formados monóxido de carbono (um gás tóxico) e fuligem (carbono elementar). A queima de um fósforo, por exemplo, em um espaço fechado com baixa quantidade de oxigênio pode gerar fumaça e monóxido de carbono.
Reações de Combustão com Metais
Certos metais, como o magnésio e o sódio, reagem vigorosamente com o oxigênio, formando óxidos metálicos. Essas reações exotérmicas liberam grande quantidade de calor, produzindo chamas brilhantes. A combustão de magnésio, por exemplo, é usada em flashes fotográficos devido à intensa luz emitida. A intensidade dessas reações depende da natureza do metal e da disponibilidade de oxigênio.
Condições para as Reações do Oxigênio
A ocorrência de reações químicas envolvendo o oxigênio é influenciada por vários fatores. A temperatura, a concentração de oxigênio e a presença de catalisadores são alguns dos parâmetros importantes. Um aumento na temperatura geralmente acelera as reações, enquanto a presença de catalisadores pode facilitar a reação, sem ser consumido no processo. A disponibilidade de oxigênio também é fundamental; reações de combustão, por exemplo, precisam de oxigênio para ocorrer.
Comparação da Reatividade do Oxigênio
A reatividade do oxigênio é comparável à de outros elementos não metálicos, como o flúor, que é o elemento mais reativo. O oxigênio, embora altamente reativo, não é tão reativo quanto o flúor. Comparado com outros não metais, como o nitrogênio, o oxigênio apresenta reatividade intermediária.
Tabela de Reações do Oxigênio
| Reagentes | Produtos | Condições |
|---|---|---|
| Metano (CH4) + Oxigênio (O2) | Dióxido de Carbono (CO2) + Água (H2O) | Presença de uma fonte de ignição |
| Magnésio (Mg) + Oxigênio (O2) | Óxido de Magnésio (MgO) | Temperatura elevada |
| Ferro (Fe) + Oxigênio (O2) | Óxido de Ferro (Fe2O3) | Umidade e ar |
História do Número Atômico do Oxigênio
O oxigênio, elemento essencial para a vida na Terra, possui uma história fascinante de descobertas e elucidações científicas. Sua trajetória, desde a sua identificação até a compreensão precisa de seu número atômico, revela a evolução do conhecimento científico ao longo dos séculos. Vamos mergulhar na jornada de descobertas que nos levaram à compreensão atual do elemento oxigênio.A compreensão do oxigênio, como um elemento individual, evoluiu ao longo de um período significativo.
Inicialmente, sua presença e importância em diversos processos químicos e biológicos foram percebidas, mas a sua natureza fundamental como um elemento distinto permaneceu obscurecida até descobertas mais recentes.
Descoberta do Oxigênio
A descoberta do oxigênio foi um processo gradual, impulsionado por diversas mentes brilhantes que, com dedicação e persistência, desvendaram os segredos desse elemento vital. Diversos cientistas contribuíram para a sua identificação e compreensão, e não houve um único descobridor.
“A descoberta do oxigênio foi atribuída a Joseph Priestley, que, em 1774, isolou o gás através do aquecimento de óxido de mercúrio. No entanto, Antoine Lavoisier, reconhecido por sua meticulosa análise, demonstrou a importância do oxigênio na combustão e na respiração, atribuindo-lhe um papel crucial na química.”
Determinação do Número Atômico do Oxigênio
A determinação do número atômico do oxigênio, que representa o número de prótons em seu núcleo, foi crucial para compreender sua estrutura e propriedades. Com o desenvolvimento da teoria atômica e a capacidade de medir as propriedades dos elementos, os cientistas puderam estabelecer o número atômico de forma mais precisa. O avanço na tecnologia de espectroscopia, por exemplo, permitiu aos pesquisadores identificar as características únicas do oxigênio e determinar seu lugar na tabela periódica.
Evolução do Conhecimento sobre o Número Atômico do Oxigênio
A compreensão do número atômico do oxigênio evoluiu ao longo do tempo, acompanhando os avanços na tecnologia e no entendimento da estrutura atômica. A evolução da espectroscopia, com o desenvolvimento de novos instrumentos e técnicas, permitiu uma precisão crescente na determinação das características espectrais do oxigênio. A compreensão da estrutura atômica, em particular, ajudou a esclarecer como o número atômico se relaciona com as propriedades químicas e físicas do elemento.
Tabela Cronológica da Descoberta
A história da descoberta do oxigênio e da compreensão de seu número atômico envolveu diversos cientistas e experimentos ao longo do tempo.
| Ano | Cientista | Contribuição |
|---|---|---|
| 1774 | Joseph Priestley | Isolamento do oxigênio. |
| 1775 | Antoine Lavoisier | Demonstração da importância do oxigênio na combustão e respiração. |
| 1913 | Henry Moseley | Determinação do número atômico dos elementos através da espectroscopia de raios-X. |
Número Atômico e Propriedades Periódicas
Source: manualdaquimica.com
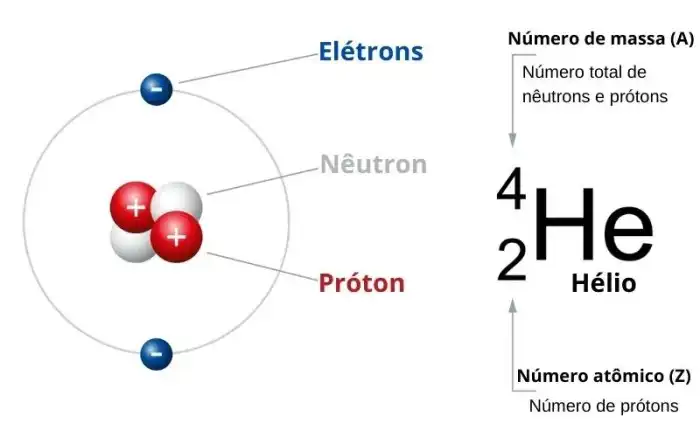
Compreender as propriedades periódicas do oxigênio é fundamental para prever seu comportamento em diversas reações químicas. Essas propriedades, intrinsecamente ligadas ao seu número atômico, 8, determinam como o oxigênio interage com outros elementos e como se manifesta em diferentes contextos químicos e físicos. A análise dessas propriedades permite predizer, por exemplo, a força de ligação com outros átomos e a tendência de formar compostos específicos.
O número atômico 8 do oxigênio influencia diretamente suas propriedades periódicas, como eletronegatividade, raio atômico, energia de ionização, afinidade eletrônica e estado de oxidação. A disposição dos elétrons na camada de valência e a força de atração do núcleo sobre esses elétrons são os principais fatores que determinam essas características. A compreensão dessas relações permite predizer o comportamento do oxigênio em diferentes situações.
Relação entre Número Atômico e Propriedades Periódicas do Oxigênio
| Propriedade Periódica | Valor/Tendência | Relação com o Número Atômico (8) | Unidade |
|---|---|---|---|
| Raio Atômico | 0,73 Å (menor que o nitrogênio) | O número atômico influencia o raio atômico por conta da força de atração entre o núcleo e os elétrons. Com 8 prótons, a atração é maior que o nitrogênio, resultando em um raio atômico menor. | Å |
| Eletronegatividade | 3,44 (alta) | A alta eletronegatividade do oxigênio decorre da forte atração do núcleo pelos elétrons da camada de valência, resultante de seu número atômico 8. | |
| Energia de Ionização | 1314 kJ/mol (segunda energia de ionização: 3388 kJ/mol) (maior que a do nitrogênio) | A alta energia de ionização reflete a dificuldade em remover elétrons da camada de valência do oxigênio. O número atômico 8 contribui para essa alta energia, pois a força de atração do núcleo pelos elétrons é intensa. | kJ/mol |
| Afinidade Eletrônica | 141 kJ/mol (alta) | A alta afinidade eletrônica do oxigênio está ligada à sua tendência em receber elétrons para completar sua camada de valência, o que é favorecido pelo número atômico 8 e a necessidade de 2 elétrons adicionais para atingir a estabilidade. | kJ/mol |
| Estado de Oxidação | -2 (comumente) | O estado de oxidação de -2 do oxigênio é resultado de sua alta eletronegatividade e sua tendência a ganhar elétrons para atingir a configuração eletrônica estável de gás nobre. |
Diferenças entre Número Atômico e Massa Atômica
Compreender as distinções entre número atômico e massa atômica é fundamental para a compreensão da estrutura e propriedades dos elementos químicos. Essas duas propriedades, embora relacionadas, fornecem informações diferentes e essenciais para descrever um elemento.
Definição de Número Atômico
O número atômico de um elemento é o número de prótons presentes no núcleo de um átomo desse elemento. Representado pela letra Z, este valor é um inteiro e exclusivo para cada elemento. Ele define a identidade do elemento químico, pois a quantidade de prótons determina a sua posição na tabela periódica. O número atômico não possui unidade de medida, sendo um valor adimensional.
Definição de Massa Atômica
A massa atômica de um elemento é a média ponderada das massas dos seus isótopos, considerando as suas abundâncias relativas na natureza. É expressa em unidades de massa atômica unificada (u), onde 1 u corresponde aproximadamente à massa de um próton ou nêutron. A massa atômica considera a contribuição de todos os núcleons (prótons e nêutrons) e, em menor medida, dos elétrons.
Diferentemente do número atômico, que é um valor inteiro, a massa atômica geralmente é um valor decimal.
Diferenças Essenciais
A principal diferença entre número atômico e massa atômica reside na informação que cada um fornece. O número atômico indica o número de prótons, definindo o elemento. A massa atômica, por outro lado, reflete a massa total dos átomos de um elemento, considerando as diferentes proporções dos seus isótopos na natureza. Um exemplo ilustrativo é o carbono. O carbono-12, o carbono-13 e o carbono-14 são isótopos de carbono, todos com 6 prótons (número atômico 6), mas com diferentes números de nêutrons e, consequentemente, diferentes massas.
Resumindo, o número atômico define a identidade do elemento, enquanto a massa atômica descreve a massa média dos átomos desse elemento, considerando a presença de diferentes isótopos.
Comparativo para o Oxigênio (O)
O oxigênio (O) possui número atômico 8, indicando que cada átomo de oxigênio possui 8 prótons em seu núcleo. Sua massa atômica é aproximadamente 15,999 u, que representa a média ponderada das massas de todos os isótopos de oxigênio, levando em conta a abundância relativa de cada um na natureza.
Tabela Comparativa
| Conceito | Valor | Unidade | Explicação |
|---|---|---|---|
| Número Atômico | 8 | – | O oxigênio possui 8 prótons em seu núcleo, o que o define como oxigênio. |
| Massa Atômica | 15,999 | u | Média ponderada das massas dos isótopos de oxigênio, considerando suas abundâncias naturais. |
Exemplo Numérico (Outros Elementos)
O cloro (Cl) possui número atômico 17, indicando que possui 17 prótons. Sua massa atômica é aproximadamente 35,45 u, que representa a média ponderada das massas dos isótopos de cloro, Cl-35 e Cl-37, presentes na natureza.
Importância do Oxigênio na Vida
O oxigênio é um elemento fundamental para a vida na Terra. Sua presença é crucial para a maioria dos processos vitais, desde a respiração até a produção de energia em organismos complexos. Este elemento desempenha um papel vital em inúmeros ciclos biogeoquímicos, sustentando a vida em nosso planeta.O oxigênio, presente na atmosfera, é essencial para a respiração de animais e plantas, e para a produção de energia nos organismos.
Compreender seu papel nos processos vitais, desde a respiração celular até o ciclo do oxigênio, é fundamental para a compreensão da vida em nosso planeta.
Respiração Celular Aeróbica, Qual É O Número Atômico Do Oxigênio
A respiração celular aeróbica é um processo complexo que envolve a quebra de moléculas orgânicas, como a glicose, na presença de oxigênio, para liberar energia na forma de ATP (adenosina trifosfato). Este processo ocorre em três etapas principais: glicólise, ciclo de Krebs e cadeia respiratória. O oxigênio atua como o aceptor final de elétrons na cadeia respiratória, permitindo a produção eficiente de ATP.
A respiração celular aeróbica é representada pela seguinte equação: C6H 12O 6 + 6O 2 → 6CO 2 + 6H 2O + Energia (ATP)
O oxigênio é vital para a absorção de nutrientes e a produção de energia. A falta de oxigênio pode levar à morte celular e a problemas de saúde.
Transporte de Oxigênio no Sangue
O oxigênio absorvido nos pulmões precisa ser transportado para as células do corpo. A hemoglobina, uma proteína presente nas hemácias (glóbulos vermelhos), desempenha um papel crucial neste processo. A hemoglobina se liga ao oxigênio, formando oxi-hemoglobina, e transporta o oxigênio para os tecidos, onde ele é liberado para a respiração celular. Este transporte eficiente é fundamental para a manutenção da vida.
Ciclo do Oxigênio na Natureza
O oxigênio participa de um ciclo biogeoquímico complexo na natureza, envolvendo diversos processos. A fotossíntese, realizada pelas plantas, é um processo fundamental neste ciclo, pois libera oxigênio para a atmosfera. A respiração de animais e plantas, bem como a decomposição de matéria orgânica, consomem oxigênio. A combustão também é um processo que consome oxigênio. Este ciclo mantém os níveis de oxigênio na atmosfera em equilíbrio.
| Etapa | Descrição | Imagem |
|---|---|---|
| Fotossíntese | Plantas e outros organismos fotossintéticos absorvem dióxido de carbono e água, utilizando a energia solar para produzir glicose e liberar oxigênio. | Imagem de uma planta realizando fotossíntese. |
| Respiração | Animais e plantas utilizam oxigênio para quebrar a glicose e liberar energia, produzindo dióxido de carbono e água. | Imagem de um animal respirando. |
| Decomposição | Organismos decompositores decompõem matéria orgânica, utilizando oxigênio e liberando dióxido de carbono. | Imagem de fungos e bactérias decompondo matéria orgânica. |
| Combustão | Processos de combustão, como a queima de combustíveis fósseis, consomem oxigênio e liberam dióxido de carbono. | Imagem de uma chama. |
Preservação Ambiental
A manutenção dos níveis de oxigênio na atmosfera depende da preservação ambiental. A degradação das florestas, a poluição e o aumento da emissão de gases de efeito estufa podem afetar negativamente o ciclo do oxigênio, comprometendo a qualidade do ar e a vida no planeta. A preservação das florestas e a adoção de práticas sustentáveis são fundamentais para a manutenção da saúde do nosso planeta.
Contexto Bioquímico do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeros processos bioquímicos, principalmente no metabolismo celular. Sua presença é vital para a obtenção de energia, a síntese de moléculas essenciais e o funcionamento geral dos organismos vivos. Vamos mergulhar no fascinante mundo da interação do oxigênio com os organismos, desde as minúsculas células até os gigantescos mamíferos.O oxigênio é essencial para a respiração celular, um processo que libera energia dos nutrientes para alimentar as atividades celulares.
Dentro das células, o oxigênio participa de reações complexas, convertendo a energia dos alimentos em uma forma utilizável para a célula. A maneira como esse processo ocorre varia entre os organismos, mas o princípio fundamental permanece o mesmo: o oxigênio é o aceptor final de elétrons, impulsionando a produção de energia.
Importância do Oxigênio para os Processos Metabólicos
O oxigênio é o aceptor final de elétrons na respiração celular, um processo fundamental para a geração de ATP, a principal moeda energética das células. A presença do oxigênio permite que as células extraiam a máxima energia dos nutrientes, como glicose, através de uma série de reações químicas. Sem oxigênio, esse processo é significativamente comprometido, limitando a produção de energia e afetando o funcionamento celular.
Utilização do Oxigênio nas Células
As células utilizam o oxigênio em uma série de reações metabólicas, principalmente na respiração celular. O oxigênio atua como um aceptor de elétrons na cadeia respiratória, uma série de complexos proteicos na membrana mitocondrial. Nessa cadeia, os elétrons liberados durante a quebra de moléculas orgânicas são transferidos para o oxigênio, que se combina com prótons para formar água.
Essa reação libera a energia necessária para a síntese de ATP.
Relação entre Oxigênio e Respiração Celular
A respiração celular aeróbica, que requer oxigênio, é o processo principal para a produção de ATP nas células eucarióticas. O oxigênio é o aceptor final de elétrons na cadeia respiratória, permitindo que os elétrons fluam de uma molécula para outra, liberando energia que é usada para bombear prótons através da membrana mitocondrial e gerar ATP. A falta de oxigênio impede a respiração celular aeróbica, levando a uma redução na produção de ATP e prejuízos significativos para a célula.
Funções do Oxigênio em Diferentes Organismos
A necessidade de oxigênio varia entre os diferentes organismos. Organismos unicelulares, como bactérias anaeróbicas, podem sobreviver sem oxigênio, utilizando outros processos metabólicos. Em contraponto, organismos multicelulares, como os mamíferos, dependem fortemente do oxigênio para a respiração celular. A adaptação evolutiva a diferentes ambientes reflete as diferentes demandas por oxigênio de cada organismo. Por exemplo, animais aquáticos desenvolveram mecanismos para extrair oxigênio da água, enquanto animais terrestres têm sistemas respiratórios especializados para captar oxigênio do ar.
Implicações da Falta de Oxigênio
A privação de oxigênio, ou hipóxia, pode ter consequências graves para os organismos. Em humanos, a hipóxia pode levar a danos celulares, isquemia e, em casos extremos, morte. A falta de oxigênio afeta a capacidade das células de produzir energia, comprometendo funções essenciais como o transporte de nutrientes e a eliminação de resíduos. A altitude elevada e doenças como a pneumonia podem provocar hipóxia, destacando a importância vital do oxigênio para a manutenção da vida.
Aplicações Médicas do Oxigênio
O oxigênio, essencial para a vida, desempenha um papel crucial na medicina moderna. Sua utilização terapêutica abrange uma ampla gama de situações, desde a suplementação respiratória até procedimentos cirúrgicos. Compreender as diferentes aplicações e protocolos de uso é fundamental para garantir o tratamento adequado e seguro.O oxigênio é um gás vital para o funcionamento do corpo humano. Sua administração terapêutica é uma ferramenta fundamental para tratar diversas condições médicas, auxiliando o organismo a obter o oxigênio necessário para as suas funções vitais.
Utilizações Terapêuticas do Oxigênio
O oxigênio é amplamente utilizado em ambientes médicos para tratar diversas condições. Sua administração pode ser feita através de diferentes métodos, adaptando-se às necessidades específicas de cada paciente. É um gás essencial para o metabolismo celular e a manutenção da vida.
- Suporte Respiratório: Em situações de insuficiência respiratória, o oxigênio suplementar pode melhorar a oxigenação do sangue e dos tecidos, garantindo a adequada função dos órgãos. Pacientes com doenças pulmonares crônicas, como enfisema e asma, frequentemente necessitam de suplementação de oxigênio para melhorar a qualidade de vida e evitar complicações.
- Tratamento de Doenças Cardíacas: Em casos de insuficiência cardíaca, o oxigênio pode ajudar a reduzir o esforço cardíaco e melhorar a oxigenação dos tecidos. A administração de oxigênio pode ser utilizada como parte de um tratamento mais amplo, que inclui medicações e outros procedimentos.
- Procedimentos Cirúrgicos: A administração de oxigênio durante e após procedimentos cirúrgicos é crucial para a recuperação do paciente. O oxigênio ajuda a minimizar o estresse fisiológico e a promover a cicatrização. É essencial para garantir o funcionamento adequado dos órgãos durante e após a intervenção cirúrgica.
Comparação com Outros Gases
O oxigênio, apesar de essencial, não é o único gás utilizado em contextos médicos. A escolha do gás apropriado depende da condição específica do paciente e dos objetivos terapêuticos. Outros gases, como o nitrogênio e o hélio, também podem ter aplicações específicas.
| Gás | Aplicações Médicas | Considerações |
|---|---|---|
| Oxigênio | Suporte respiratório, procedimentos cirúrgicos, doenças cardíacas | Essencial para a vida, mas pode causar efeitos adversos em altas concentrações. |
| Nitrogênio | Crioterapia, anestesia | Utilizado em temperaturas extremamente baixas e em misturas com outros gases. |
| Hélio | Anestesia, tratamento de problemas respiratórios em crianças | Mais leve que o ar, usado em alguns casos de obstrução respiratória. |
Protocolos e Cuidados com o Uso Médico do Oxigênio
A administração de oxigênio requer protocolos específicos para garantir a segurança e eficácia do tratamento. O profissional de saúde deve considerar a condição do paciente, o método de administração e a concentração de oxigênio. A utilização inadequada pode causar danos.
O uso inadequado de oxigênio pode levar a problemas de saúde, como danos pulmonares e outros efeitos adversos.
A administração de oxigênio deve ser feita por profissionais qualificados, seguindo os protocolos e diretrizes estabelecidas. É importante monitorar cuidadosamente a resposta do paciente e ajustar o tratamento de acordo com a necessidade.
Ilustrações do Oxigênio
O oxigênio, elemento essencial para a vida na Terra, manifesta-se em diversas formas e estados. Compreender sua estrutura atômica, suas diferentes formas moleculares e suas aplicações é fundamental para apreciar sua importância. As ilustrações a seguir visam tornar esses conceitos mais tangíveis e interessantes.
Representação do Átomo de Oxigênio
O átomo de oxigênio, com número atômico 8, possui 8 prótons e 8 elétrons. Sua estrutura atômica, representada por um núcleo central contendo prótons e nêutrons, e uma nuvem eletrônica onde os elétrons orbitam, pode ser ilustrada como um pequeno círculo representando o núcleo, rodeado por pequenos pontos ou círculos menores que representam os elétrons em suas diferentes camadas.
Os elétrons em diferentes camadas têm níveis de energia distintos. Uma ilustração detalhada mostraria as duas camadas eletrônicas do átomo de oxigênio, com 2 elétrons na camada mais interna e 6 na camada mais externa. Essa representação visual facilita a compreensão da estrutura e comportamento químico do oxigênio.
Estruturas do Oxigênio em Diferentes Formas
O oxigênio pode existir em diferentes formas moleculares, dependendo das ligações entre seus átomos. A forma mais comum é a molécula diatômica de oxigênio (O 2). Uma ilustração poderia mostrar dois átomos de oxigênio unidos por uma ligação covalente dupla, enfatizando a estrutura molecular. Outras formas alotrópicas do oxigênio, como o ozônio (O 3), poderiam ser ilustradas mostrando três átomos de oxigênio conectados em uma estrutura angular, destacando as diferentes propriedades químicas e físicas dessas formas.
A representação gráfica permite a comparação das diferentes formas moleculares e suas consequentes propriedades.
Aplicações do Oxigênio
O oxigênio tem inúmeras aplicações em diversas áreas. Uma ilustração representativa poderia mostrar diversas situações, incluindo: um mergulhador usando um cilindro de oxigênio, um paciente em um respirador artificial, um forno industrial utilizando oxigênio para combustão, e uma usina de produção de aço. Essas imagens visuais demonstram a importância do oxigênio na medicina, indústria e em diversas atividades humanas.
Oxigênio em Diferentes Estados Físicos
O oxigênio pode existir em três estados físicos: sólido, líquido e gasoso. Uma ilustração representando esses três estados poderia apresentar um cubo de gelo contendo oxigênio sólido, um recipiente com oxigênio líquido e um balão inflado com oxigênio gasoso. A ilustração também poderia incluir gráficos ou tabelas que mostrem as temperaturas e pressões correspondentes a cada estado físico, auxiliando na compreensão das mudanças de estado do oxigênio.
Cada estado físico apresenta propriedades distintas, que são visíveis nas imagens.
Concluímos nossa jornada pelo fascinante mundo do oxigênio e seu número atômico. Esperamos que você tenha aprendido algo novo e interessante sobre esse elemento essencial para a vida. Da sua estrutura atômica às suas propriedades químicas e aplicações, exploramos um universo de informações. Esperamos que esta viagem tenha sido informativa e divertida!
Qual a importância do número atômico para identificar um elemento?
O número atômico é a identidade de um elemento, pois indica o número de prótons em seu núcleo. Cada elemento tem um número atômico único, assim como cada pessoa tem um CPF único.
Quais são os isótopos estáveis do oxigênio?
Os três isótopos estáveis do oxigênio são 16O, 17O e 18O.
Como a fotossíntese afeta a quantidade de oxigênio na atmosfera?
A fotossíntese é o principal processo responsável pela produção de oxigênio atmosférico, liberando-o como subproduto. Organismos fotossintetizantes, como plantas e algas, desempenham um papel crucial nesse processo.
Qual a diferença entre número atômico e massa atômica?
O número atômico indica o número de prótons no núcleo, enquanto a massa atômica é a média ponderada das massas dos isótopos de um elemento, considerando suas abundâncias relativas.







