Qual O Número Atômico Do Oxigênio? Prepare-se para uma aventura fascinante pelo mundo minúsculo dos átomos! Vamos desvendar os segredos do oxigênio, explorando sua posição na tabela periódica e sua importância para a vida e para a indústria. Descubra como seu número atômico define sua identidade e sua estrutura atômica, desvendando seus isótopos e propriedades únicas. Prepare-se para mergulhar em um universo de descobertas!
O oxigênio, elemento vital para a vida na Terra, possui um número atômico fundamental para sua identificação. Este número atômico revela detalhes intrincados sobre a estrutura do átomo de oxigênio, incluindo o número de prótons em seu núcleo e a distribuição de seus elétrons em torno dele. Vamos explorar as implicações deste número para a química e a vida!
Número Atômico do Oxigênio
Source: passeidireto.com
O número atômico é uma propriedade fundamental que define cada elemento químico na tabela periódica. Ele revela informações cruciais sobre a estrutura interna do átomo, incluindo o número de prótons em seu núcleo. Compreender esse conceito é essencial para desvendar as características únicas de cada elemento, como o oxigênio.
Conceito de Número Atômico
O número atômico de um elemento corresponde ao número de prótons presentes no núcleo de seu átomo. Cada elemento possui um número atômico único, que o distingue de todos os outros elementos. Este número é fundamental para a organização da tabela periódica, pois elementos com o mesmo número atômico compartilham propriedades químicas semelhantes. Essa característica é crucial para a classificação e compreensão das reações químicas.
Importância do Número Atômico na Identificação de Elementos Químicos
O número atômico diferencia os elementos químicos. O hidrogênio, com número atômico 1, é diferente do oxigênio, com número atômico 8, porque possui um número distinto de prótons em seu núcleo. Essa distinção é essencial para prever o comportamento químico dos elementos e suas interações. A tabela periódica organiza os elementos em ordem crescente de número atômico, refletindo as tendências periódicas em suas propriedades.
Relação com a Estrutura Atômica do Oxigênio
O oxigênio, com número atômico 8, possui 8 prótons em seu núcleo. O número de nêutrons pode variar, existindo diferentes isótopos de oxigênio. Um isótopo comum possui 8 nêutrons. Ao redor do núcleo, 8 elétrons orbitam em diferentes níveis de energia, organizados em camadas eletrônicas. A distribuição desses elétrons nas camadas determina as propriedades químicas do oxigênio, incluindo sua capacidade de formar ligações químicas.
Tabela de Elementos Químicos
| Elemento | Símbolo | Número Atômico | Massa Atômica |
|---|---|---|---|
| Oxigênio | O | 8 | 15,999 |
| Hidrogênio | H | 1 | 1,008 |
| Carbono | C | 6 | 12,011 |
História e Descoberta do Oxigênio
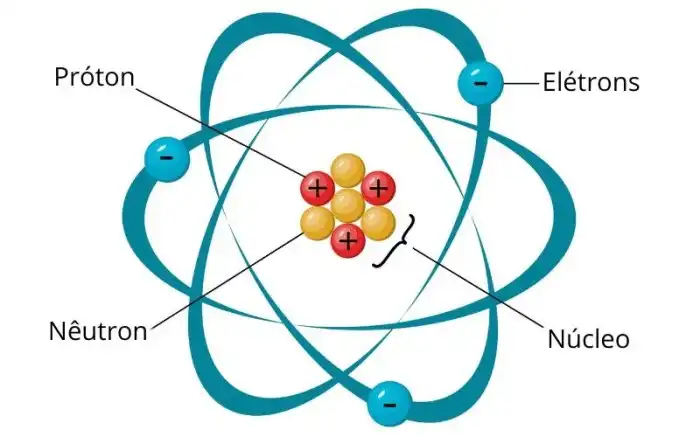
Source: manualdaquimica.com
A descoberta do oxigênio, um elemento fundamental para a vida e para inúmeros processos químicos, foi um processo gradual e envolveu a colaboração de diversos cientistas ao longo de décadas. A compreensão da composição do ar e dos mecanismos da combustão passou por transformações significativas, culminando na identificação e caracterização desse gás vital.
Cientistas Envolvidos na Descoberta
A tabela a seguir apresenta os cientistas que contribuíram para a descoberta do oxigênio, seus períodos históricos e suas respectivas contribuições.
| Nome | Nacionalidade | Período Histórico | Experiências/Observações | Contribuições para a descoberta do oxigênio |
|---|---|---|---|---|
| Joseph Priestley | Britânico | Século XVIII | Realizou experimentos aquecendo óxido de mercúrio (II), observando a liberação de um gás que sustentava a combustão mais vigorosamente do que o ar comum. Também estudou a reação de diversos materiais com o gás. | Priestley, embora não tenha compreendido completamente a natureza do gás, foi o primeiro a isolar o oxigênio. |
| Carl Wilhelm Scheele | Sueco | Século XVIII | Independentemente de Priestley, Scheele isolou o oxigênio através do aquecimento de diversos óxidos, como nitratos e sais de potássio. | Scheele também isolou o oxigênio, mas sua publicação foi posterior à de Priestley. |
| Antoine Lavoisier | Francês | Século XVIII | Realizou experimentos meticulosos com o gás isolado por Priestley e Scheele, demonstrando sua importância na combustão e na respiração. Lavoisier demonstrou que o ar é uma mistura de gases, e que o oxigênio era um componente crucial para a combustão. | Lavoisier foi fundamental para a compreensão da natureza do oxigênio, nomeando-o e propondo uma teoria mais completa sobre sua função na combustão e na respiração. |
Teorias sobre a Composição do Ar
Antes da descoberta do oxigênio, a composição do ar era vista de formas diferentes. A teoria do flogisto, por exemplo, defendia que a combustão era um processo de liberação de uma substância chamada “flogisto”.
“A teoria do flogisto propunha que todas as substâncias combustíveis continham flogisto, que era liberado durante a combustão. Esta teoria, apesar de inicialmente bem-sucedida, falhava em explicar a variação de massa durante a combustão.”
Outras teorias postulavam a presença de diferentes “espíritos” ou elementos no ar, sem uma compreensão clara de suas proporções ou propriedades. Essas teorias não explicavam satisfatoriamente a natureza da combustão ou a variação de massa que ocorria nos experimentos.
Linha do Tempo
A seguir, uma linha do tempo dos principais marcos na descoberta do oxigênio:
- 1774: Joseph Priestley isola o oxigênio, embora sem compreender completamente sua natureza.
- 1774: Carl Wilhelm Scheele também isola o oxigênio, independentemente de Priestley.
- 1775: Antoine Lavoisier nomeia o elemento como “oxigênio” e demonstra sua importância na combustão e na respiração.
- 1777: Lavoisier explica a importância do oxigênio na combustão, refutando a teoria do flogisto.
Estrutura Atômica do Oxigênio

Source: infoescola.com
O oxigênio, elemento essencial para a vida na Terra, possui uma estrutura atômica fascinante que explica suas propriedades químicas. Compreender essa estrutura é fundamental para entender como o oxigênio interage com outros elementos e forma compostos. Vamos mergulhar no mundo microscópico do oxigênio e desvendar seus segredos atômicos!
Número Atômico e Massa Atômica
O número atômico do oxigênio (Z) é 8, o que significa que cada átomo de oxigênio possui 8 prótons em seu núcleo. O isótopo mais comum do oxigênio é o 16O, que tem um número de massa (A) de 16. O número de massa é a soma do número de prótons e nêutrons no núcleo. Portanto, o número de nêutrons no isótopo 16O é 16 – 8 = 8.
Distribuição Eletrônica
Os elétrons de um átomo ocupam níveis de energia diferentes, chamados camadas eletrônicas. A distribuição eletrônica do oxigênio em notação espectroscópica é 1s 22s 22p 4. Isso indica que existem 2 elétrons na primeira camada (1s), 2 elétrons na segunda camada (2s) e 4 elétrons na segunda camada, distribuídos em três orbitais p (2p). A configuração eletrônica em níveis de energia (camadas) é: primeira camada (K) com 2 elétrons e segunda camada (L) com 6 elétrons.
Camadas Eletrônicas Detalhada
As camadas eletrônicas, também conhecidas como níveis de energia, são regiões ao redor do núcleo onde os elétrons podem ser encontrados. Cada camada tem uma quantidade máxima de elétrons que pode conter. A primeira camada (K) comporta no máximo 2 elétrons, a segunda camada (L) comporta no máximo 8 elétrons e a terceira camada (M) comporta no máximo 18 elétrons, e assim por diante.
A tabela a seguir resume as características das camadas eletrônicas do oxigênio:
| Camada | Subcamada | Número Quântico Principal (n) | Número Máximo de Elétrons | Número de Elétrons em Oxigênio |
|---|---|---|---|---|
| K (n=1) | s | 1 | 2 | 2 |
| L (n=2) | s, p | 2 | 8 | 6 |
| Total | 8 |
A camada K, com n=1, contém a subcamada s. A camada L, com n=2, contém as subcamadas s e p. Cada subcamada contém orbitais, definidos pelos números quânticos azimutais. Os orbitais são regiões tridimensionais onde a probabilidade de encontrar um elétron é maior. Os números quânticos magnéticos descrevem a orientação espacial dos orbitais.
A energia relativa das camadas eletrônicas aumenta com o aumento do valor de n. A primeira camada (K) tem menor energia do que a segunda camada (L).
Comparação com Outros Elementos
O oxigênio, como calcogênio, compartilha algumas semelhanças na estrutura eletrônica com outros elementos da mesma família, como o enxofre. Por outro lado, o oxigênio difere do nitrogênio, que é do período anterior, devido à adição de um nível de energia na camada eletrônica. O flúor, por sua vez, possui uma configuração eletrônica com um elétron a mais na camada de valência.
O carbono, por exemplo, possui uma estrutura atômica diferente, com apenas dois níveis de energia, o que leva a propriedades químicas distintas. As diferenças na estrutura atômica são a chave para as diferentes propriedades químicas dos elementos, como reatividade, ponto de fusão e ebulição.
Diagrama da Estrutura Atômica do Oxigênio (HTML)

O diagrama acima ilustra a estrutura atômica do oxigênio. As cores representam as camadas eletrônicas (K e L) e os pontos representam os elétrons. Clique em um elétron para ver informações detalhadas.
Propriedades do Oxigênio
O oxigênio, elemento essencial para a vida na Terra, apresenta uma gama fascinante de propriedades físicas e químicas que o tornam único. Compreender essas propriedades é fundamental para apreciar sua importância em diversos processos, desde a respiração até as combustões. Vamos mergulhar nesse universo de características intrigantes!
Estado Físico e Propriedades Físicas
O oxigênio, em condições ambientes, é um gás incolor, inodoro e insípido. Sua existência como gás à temperatura ambiente é uma propriedade que diferencia o oxigênio de outros elementos, como o carbono, que pode existir em diferentes estados (sólido, líquido e gasoso). Sua forma gasosa é crucial para sua interação com outros elementos e compostos.
Ponto de Fusão e Ponto de Ebulição
O oxigênio apresenta pontos de fusão e ebulição extremamente baixos, comparados a outros elementos. A baixa temperatura de fusão (-218,4 °C) e de ebulição (-182,96 °C) contribuem para sua presença predominantemente em estado gasoso nas condições da superfície terrestre. Isso facilita sua movimentação e participação em reações químicas.
Densidade
A densidade do oxigênio é menor que a do ar, o que explica por que ele é um gás que flutua no ar. Esta característica é relevante para entender como o oxigênio se distribui na atmosfera e como é transportado para os organismos vivos.
Reatividade
O oxigênio é um elemento altamente reativo, desempenhando um papel crucial em diversas reações químicas. Sua alta reatividade é atribuída à sua capacidade de formar ligações químicas com uma variedade de outros elementos, dando origem a óxidos e outros compostos.
Reações Químicas Comuns
O oxigênio participa de reações de combustão, que são reações químicas que envolvem a combinação do oxigênio com outros materiais, liberando energia na forma de calor e luz. Um exemplo clássico é a combustão de madeira ou gasolina. Além disso, o oxigênio é essencial para a respiração, onde é utilizado para liberar energia dos alimentos. Outro exemplo de reação química comum do oxigênio é a formação de ferrugem, um processo de oxidação do ferro.
Comparação com Outros Elementos Não-Metálicos
Comparando o oxigênio com outros elementos não-metálicos, como o nitrogênio e o flúor, nota-se que a reatividade do oxigênio se situa entre os dois. O oxigênio é menos reativo que o flúor, mas mais reativo que o nitrogênio, refletindo sua posição na tabela periódica. Essa diferença de reatividade é crucial para compreender as diversas funções do oxigênio nos sistemas biológicos e químicos.
Propriedades do Oxigênio em Tabela
| Propriedade | Valor | Unidade |
|---|---|---|
| Estado Físico | Gasoso | – |
| Ponto de Fusão | -218,4 | °C |
| Ponto de Ebulição | -182,96 | °C |
| Densidade (a 0 °C e 1 atm) | 1,429 | g/L |
| Número Atômico | 8 | – |
Isótopos do Oxigênio
Source: conceitos.com
Os átomos de um mesmo elemento químico podem apresentar diferentes números de massa, devido à variação no número de nêutrons em seus núcleos. Esses átomos, com o mesmo número atômico, mas diferentes números de massa, são conhecidos como isótopos. Compreender os isótopos do oxigênio é fundamental para entender sua abundância na natureza e suas propriedades.
Conceito de Isótopos
Isótopos são átomos do mesmo elemento químico que possuem o mesmo número atômico, mas diferentes números de massa. O número atômico representa o número de prótons no núcleo do átomo, enquanto o número de massa representa a soma do número de prótons e nêutrons. A diferença entre os isótopos de um elemento reside no número de nêutrons em seus núcleos.
Isótopos do Oxigênio
O oxigênio, um elemento essencial para a vida, possui três isótopos estáveis: ¹⁶O, ¹⁷O e ¹⁸O. Cada um desses isótopos apresenta um número diferente de nêutrons, resultando em diferentes números de massa. A abundância relativa desses isótopos na natureza influencia suas propriedades físicas e químicas.
- ¹⁶O: Este é o isótopo mais abundante, representando cerca de 99,76% do oxigênio encontrado na natureza. Seu número atômico é 8 e seu número de massa é 16. É o isótopo mais estável e mais comum.
- ¹⁷O: Este isótopo possui 9 nêutrons, o que lhe confere um número de massa de 17. Sua abundância é de aproximadamente 0,04% na natureza.
- ¹⁸O: Este isótopo possui 10 nêutrons, o que lhe confere um número de massa de 18. Sua abundância é de aproximadamente 0,20% na natureza.
Propriedades dos Isótopos do Oxigênio
Embora os isótopos do oxigênio compartilhem as mesmas propriedades químicas em grande parte, pequenas diferenças em suas massas atômicas podem influenciar levemente suas propriedades físicas. Por exemplo, a velocidade de difusão de gases que contêm ¹⁸O pode ser ligeiramente menor do que a de gases que contêm ¹⁶O, devido à maior massa do ¹⁸O. As diferenças em estabilidade são mínimas entre os isótopos estáveis.
A reatividade química do oxigênio, em geral, não varia significativamente entre os isótopos.
Diagrama HTML dos Isótopos do Oxigênio
<table border="1">
<tr>
<th>Símbolo</th>
<th>Número Atômico</th>
<th>Número de Massa</th>
<th>Abundância (%)</th>
<th>Descrição</th>
</tr>
<tr>
<td>¹⁶O</td>
<td>8</td>
<td>16</td>
<td>99,76</td>
<td>Isótopo mais abundante e estável.</td>
</tr>
<tr>
<td>¹⁷O</td>
<td>8</td>
<td>17</td>
<td>0,04</td>
<td>Abundância relativamente baixa.</td>
</tr>
<tr>
<td>¹⁸O</td>
<td>8</td>
<td>18</td>
<td>0,20</td>
<td>Abundância relativamente baixa.</td>
</tr>
</table>
A tabela acima apresenta uma representação dos isótopos do oxigênio, exibindo seus símbolos, números atômicos, números de massa, abundância relativa e uma breve descrição. Este diagrama visual facilita a compreensão das diferenças entre os isótopos.
Ocorrência do Oxigênio na Natureza
O oxigênio, elemento vital para a vida na Terra, é encontrado em uma ampla variedade de formas e locais na natureza. Sua presença fundamental em compostos orgânicos e inorgânicos, bem como sua importância crucial na atmosfera, define sua essencialidade para os ecossistemas terrestres e aquáticos. Vamos explorar detalhadamente essa presença diversificada.
Localização na Natureza
O oxigênio está presente em diversos ambientes, desempenhando papéis distintos. Sua ocorrência varia desde a atmosfera, onde ele é abundante, até minerais em rochas, e até mesmo em componentes de organismos vivos.
- Atmosfera: O oxigênio molecular (O 2) é o principal componente do ar que respiramos, representando cerca de 21% da composição atmosférica. Essa concentração é essencial para a manutenção da vida aeróbica, permitindo a respiração e a combustão. A atmosfera funciona como um reservatório de oxigênio, crucial para os processos vitais.
- Água: O oxigênio está presente na água na forma dissolvida, fundamental para a respiração aquática. A molécula de água (H 2O) contém oxigênio, sendo crucial para os processos metabólicos de organismos aquáticos.
- Rochas e Minerais: O oxigênio é um componente de numerosos minerais e rochas. Ele está presente em óxidos, silicatos e outros compostos inorgânicos, formando a base de grande parte da crosta terrestre. A presença de oxigênio na estrutura de minerais é fundamental para a composição e estabilidade de diversos materiais geológicos.
- Organismos Vivos: O oxigênio é um elemento vital em diversas moléculas orgânicas, como proteínas, carboidratos e lipídios. Ele participa de processos essenciais para a vida, como a respiração celular, a fotossíntese e a produção de energia. A presença de oxigênio em moléculas orgânicas é fundamental para a estrutura e função dos organismos vivos.
Importância Atmosférica
A presença de oxigênio na atmosfera terrestre é crucial para a manutenção da vida como a conhecemos. Sua concentração e a forma como é utilizado pelos organismos vivos moldam o equilíbrio dos ecossistemas.
A atmosfera terrestre contém aproximadamente 21% de oxigênio, uma proporção essencial para a vida aeróbica. A respiração, a combustão e outros processos biológicos dependem do oxigênio atmosférico para ocorrer. O oxigênio é o principal aceptor de elétrons na respiração aeróbica, liberando energia para os organismos vivos. A disponibilidade de oxigênio na atmosfera também afeta a taxa de decomposição da matéria orgânica.
Presença em Compostos Naturais
O oxigênio está presente em uma variedade de compostos naturais, orgânicos e inorgânicos, desempenhando funções essenciais em seus processos.
- Inorgânicos: A água (H 2O) é um exemplo fundamental, essencial para a vida e com grande importância em reações químicas. O dióxido de carbono (CO 2) é outro exemplo crucial para a fotossíntese, sendo uma importante molécula que participa do ciclo do carbono. Os óxidos metálicos, como o óxido de ferro (Fe 2O 3), são exemplos de compostos inorgânicos que contêm oxigênio.
- Orgânicos: O oxigênio é um elemento chave na composição de moléculas orgânicas como açúcares (C 6H 12O 6), proteínas e lipídios. Ele participa de ligações químicas cruciais para a estrutura e função dessas moléculas, como as ligações glicosídicas nos carboidratos e as ligações peptídicas nas proteínas.
Diagrama HTML (Exemplo)
Um diagrama para ilustrar a ocorrência do oxigênio na natureza poderia ser uma tabela HTML com colunas para “Local”, “Forma do Oxigênio”, “Exemplo de Composto” e “Imagem”. A tabela deve ser responsiva para diferentes dispositivos.
Local
Forma do Oxigênio
Exemplo de Composto
Imagem
Atmosfera
Gás (O2)
Ar
(Imagem representativa do ar)
Água
Dissolvido (O2)
H2O
(Imagem representativa da água)
Rochas
Parte de minerais
Óxido de ferro (Fe2O 3)
(Imagem representativa de uma rocha)
Organismos Vivos
Parte de moléculas orgânicas
Açúcar (C6H 12O 6)
(Imagem representativa de uma célula)
Aplicações do Oxigênio: Qual O Número Atômico Do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras atividades humanas, desde a respiração até processos industriais complexos.
Sua versatilidade se estende a aplicações médicas, científicas e tecnológicas, moldando nossa sociedade de maneiras notáveis. Vamos explorar esse elemento vital e suas diversas utilidades.
O oxigênio, um gás incolor, inodoro e insípido, é essencial para a combustão. Sua presença, em diversas formas, é fundamental em diferentes setores, desde a produção de aço até a manutenção da vida em ambientes hospitalares. A compreensão de suas aplicações é crucial para apreciar sua importância em nossa realidade.
Aplicações na Indústria
O oxigênio desempenha um papel fundamental em inúmeras operações industriais. Sua utilização como oxidante impulsiona processos que variam desde a produção de aço até a fabricação de diversos produtos químicos.
- Produção de Aço: O oxigênio é essencial na conversão de minério de ferro em aço. O uso de jatos de oxigênio promove uma queima mais eficiente, resultando em um aço de melhor qualidade e maior rendimento. A utilização do oxigênio nesse processo reduz o tempo e os custos de produção, tornando-o um elemento vital para a indústria siderúrgica.
- Soldagem e Corte: O oxigênio, combinado com outros gases, é empregado na soldagem e corte de metais. A combinação de oxigênio com outros gases, como o acetileno, gera uma chama com alta temperatura, ideal para fusão e corte de materiais metálicos. Esse processo é amplamente utilizado em indústrias de construção, manutenção e reparação.
- Produção de Produtos Químicos: O oxigênio é um reagente fundamental na síntese de diversos produtos químicos. Sua utilização em reações de oxidação permite a produção de substâncias como o dióxido de enxofre, peróxido de hidrogênio e outros compostos químicos essenciais para indústrias de diversos setores.
Aplicações na Medicina
O oxigênio é vital para a manutenção da vida humana. Seu uso em ambientes médicos é crucial para a terapia respiratória, garantindo o suprimento adequado de oxigênio para pacientes com dificuldades respiratórias.
- Terapia com Oxigênio: Em situações de insuficiência respiratória, o oxigênio é administrado para auxiliar o corpo a obter o oxigênio necessário. Equipamentos como cilindros de oxigênio e máscaras são amplamente utilizados para fornecer oxigênio suplementar a pacientes em necessidade. A administração adequada de oxigênio pode ser a diferença entre a vida e a morte em casos de asfixia, doenças pulmonares ou traumas.
- Cirurgias: Em procedimentos cirúrgicos, o oxigênio pode ser usado para manter a oxigenação adequada dos tecidos durante o processo cirúrgico. Isso garante o funcionamento normal dos órgãos e tecidos, minimizando o risco de danos causados pela falta de oxigênio.
Aplicações na Pesquisa Científica
O oxigênio é um elemento chave em diversas pesquisas científicas, permitindo investigações em diferentes áreas do conhecimento. Sua importância em processos de oxidação e combustão é fundamental para a compreensão de diversos fenômenos naturais.
- Estudo de Reações Químicas: O oxigênio é essencial na compreensão de reações de oxidação. Pesquisadores utilizam o oxigênio para estudar as taxas de reação, mecanismos de reação e as implicações dessas reações em diferentes contextos.
- Modelagem de Atmosferas Planetárias: A presença de oxigênio em atmosferas planetárias é um fator determinante na caracterização de planetas e na busca por vida fora da Terra. A pesquisa sobre o papel do oxigênio em atmosferas diferentes da terrestre é crucial para o entendimento da formação e evolução dos planetas.
Comparação das Aplicações
As aplicações do oxigênio variam amplamente, desde a produção industrial até a manutenção da vida humana. Apesar das diferenças, todas as aplicações dependem da capacidade do oxigênio de participar de reações químicas e promover o fornecimento de energia.
| Tipo de Aplicação | Detalhes |
|---|---|
| Industrial | Essencial para a produção de aço, soldagem, corte e síntese de produtos químicos. |
| Médica | Fundamental na terapia respiratória, garantindo o suprimento de oxigênio a pacientes com dificuldades respiratórias. |
| Pesquisa Científica | Utilização em estudos sobre reações químicas, modelagem de atmosferas planetárias e outros processos científicos. |
Reações Químicas Envolvendo o Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras reações químicas. Sua alta reatividade o torna um agente oxidante poderoso, envolvido em processos desde a combustão até a respiração celular. Neste tópico, exploraremos detalhadamente as reações químicas envolvendo o oxigênio, incluindo combustão, oxidação e redução.
Combustão
A combustão é uma reação química rápida e exotérmica entre um combustível e um oxidante, geralmente o oxigênio. A velocidade e a intensidade da combustão dependem das condições de reação, como temperatura e disponibilidade de oxigênio. A combustão pode ser completa ou incompleta, resultando em diferentes produtos.
- Combustão Completa: Neste tipo de combustão, há uma quantidade suficiente de oxigênio disponível para reagir completamente com o combustível, formando dióxido de carbono (CO 2) e água (H 2O) como principais produtos. A combustão completa é desejável em muitas aplicações, pois produz menos poluentes do que a combustão incompleta. Exemplo: a queima completa de metano (CH 4) em presença de oxigênio (O 2): CH 4 + 2O 2 → CO 2 + 2H 2O.
- Combustão Incompleta: Quando a quantidade de oxigênio é insuficiente para a reação completa, forma-se monóxido de carbono (CO) além de dióxido de carbono (CO 2) e água (H 2O). O monóxido de carbono é um gás tóxico e prejudicial à saúde. Exemplo: a queima incompleta de madeira: C 6H 10O 5 + O 2 → CO 2 + CO + H 2O.
A presença de oxigênio é fundamental para a ocorrência da combustão, pois atua como oxidante, fornecendo elétrons para o combustível.
Oxidação
A oxidação é uma reação química na qual um elemento perde elétrons, geralmente em presença de um agente oxidante, como o oxigênio. Este processo é fundamental em muitos processos químicos e biológicos. A oxidação de metais é um exemplo comum.
- Oxidação de Metais: Metais, como ferro (Fe), cobre (Cu) e magnésio (Mg), sofrem oxidação em contato com o oxigênio, formando óxidos metálicos. Exemplo: a oxidação do ferro (corrosão): 4Fe + 3O 2 → 2Fe 2O 3. O oxigênio atua como um forte agente oxidante, extraindo elétrons dos átomos de metal.
Redução
A redução é o processo inverso da oxidação, onde um elemento ganha elétrons. O oxigênio, em algumas reações, pode ser reduzido.
- Redução do Oxigênio: A formação de água (H 2O) a partir da reação do oxigênio (O 2) com o hidrogênio (H 2) é um exemplo de redução do oxigênio: 2H 2 + O 2 → 2H 2O. Neste caso, o oxigênio ganha elétrons, passando de um estado de oxidação 0 para -2.
Tabela de Reações Químicas
| Reagentes | Produtos | Condições de Reação | Tipo de Reação | Exemplo |
|---|---|---|---|---|
| Metano (CH₄), Oxigênio (O₂) | Dióxido de Carbono (CO₂), Água (H₂O) | Temperatura elevada | Combustão | Combustão completa do metano em presença de oxigênio. |
| Ferro (Fe), Oxigênio (O₂) | Óxido de Ferro (Fe₂O₃) | Temperatura ambiente | Oxidação | Corrosão do ferro. |
| Hidrogênio (H₂), Oxigênio (O₂) | Água (H₂O) | Faísca ou alta temperatura | Redução/Combustão | Formação de água a partir da reação do hidrogênio com o oxigênio. |
Importância Biológica do Oxigênio
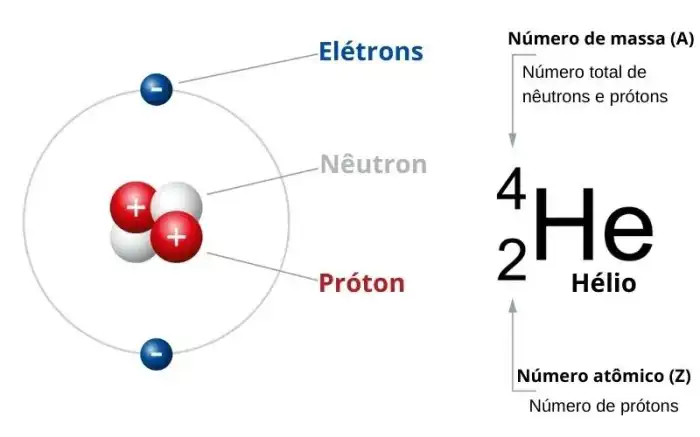
Source: manualdaquimica.com
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em diversos processos biológicos. Sua presença é essencial para a sobrevivência de uma ampla gama de organismos, desde minúsculos microrganismos até os maiores mamíferos. Neste tópico, exploraremos a importância do oxigênio para a respiração celular, a fotossíntese e como sua presença varia entre diferentes seres vivos.
Respiração Celular: O Combustível da Vida
A respiração celular é o processo pelo qual as células extraem energia dos nutrientes, principalmente glicose. O oxigênio atua como o aceptor final de elétrons nessa complexa cadeia de reações químicas. Sem oxigênio, a respiração celular aeróbica não pode ocorrer, limitando a produção de energia necessária para as atividades celulares. Essa energia, na forma de ATP (adenosina trifosfato), impulsiona uma infinidade de processos vitais, desde o movimento muscular até a síntese de proteínas.
Em resumo, o oxigênio é vital para a liberação de energia dos alimentos, tornando possível a vida como a conhecemos.
Fotossíntese: A Produção de Oxigênio
A fotossíntese é o processo pelo qual plantas, algas e certas bactérias convertem a energia solar em energia química, na forma de glicose. Durante a fotossíntese, o dióxido de carbono é absorvido e o oxigênio é liberado como subproduto. Esse processo é fundamental para a manutenção da vida na Terra, pois fornece o oxigênio essencial para a respiração celular e remove o dióxido de carbono da atmosfera.
A fotossíntese é a base da cadeia alimentar, fornecendo alimento e oxigênio para a maioria dos organismos.
Importância do Oxigênio para Diferentes Organismos
A necessidade de oxigênio varia entre diferentes organismos. Alguns organismos, como os animais vertebrados, dependem exclusivamente do oxigênio atmosférico para sua respiração. Outros organismos, como certas bactérias anaeróbicas, podem sobreviver sem oxigênio, utilizando outros processos metabólicos para obter energia. A adaptação dos organismos ao ambiente em que vivem, seja rico ou pobre em oxigênio, demonstra a versatilidade da vida e a importância do oxigênio para a manutenção da diversidade biológica.
Ciclo do Oxigênio na Natureza
O ciclo do oxigênio é um processo contínuo que envolve a fotossíntese e a respiração. A figura a seguir ilustra este ciclo, mostrando a relação entre esses dois processos essenciais para a vida na Terra.
| Processo | Descrição |
|---|---|
| Fotossíntese | Plantas, algas e certas bactérias absorvem dióxido de carbono e liberam oxigênio. |
| Respiração | Animais e outros organismos consomem oxigênio e liberam dióxido de carbono. |
A fotossíntese e a respiração são processos interligados que garantem a circulação contínua de oxigênio na atmosfera. A fotossíntese produz o oxigênio, que é utilizado na respiração, e a respiração produz o dióxido de carbono, que é utilizado na fotossíntese. Este ciclo contínuo mantém o equilíbrio do oxigênio no planeta.
Número Atômico e a Tabela Periódica
A tabela periódica é uma ferramenta fundamental para organizar e compreender as propriedades dos elementos químicos. Ela nos permite visualizar as relações entre os elementos, suas características e como eles se comportam em reações químicas. Imagine uma biblioteca organizada por categorias, onde cada elemento ocupa um lugar específico, revelando informações importantes sobre suas propriedades. O oxigênio, nosso protagonista de hoje, ocupa um lugar especial nessa biblioteca.O número atômico de um elemento, como o oxigênio, é a chave para entender sua posição e propriedades na tabela periódica.
Ele representa o número de prótons presentes no núcleo de um átomo do elemento. Cada elemento possui um número atômico único, que determina sua identidade e suas características. Essa singularidade é crucial para classificar e compreender as propriedades químicas e físicas dos elementos.
Posição do Oxigênio na Tabela Periódica
O oxigênio, com número atômico 8, encontra-se no grupo 16 (antigo grupo VI A) e no período 2 da tabela periódica. Sua posição reflete as características semelhantes dos elementos do seu grupo, como o enxofre, o selênio e o telúrio. A localização específica do oxigênio revela informações valiosas sobre sua reatividade e comportamento químico.
Relação entre Número Atômico e Propriedades do Oxigênio
O número atômico 8 do oxigênio influencia diretamente suas propriedades. A quantidade de prótons no núcleo afeta a atração exercida pelos elétrons, determinando a reatividade do elemento. O oxigênio é um elemento altamente reativo, formando compostos com a maioria dos elementos. Sua reatividade é consequência da necessidade de completar seu octeto eletrônico, o que o leva a ganhar dois elétrons em ligações químicas.
Diagrama da Tabela Periódica (Fragmento)
| Grupo | Período | Elemento | Número Atômico | Configuração Eletrônica | Estado Físico (25°C) |
|---|---|---|---|---|---|
| 16 | 2 | Oxigênio (O) | 8 | 1s22s22p4 | Gás |
| 16 | 3 | Enxofre (S) | 16 | 1s22s22p63s23p4 | Sólido |
Este pequeno fragmento da tabela periódica destaca a posição do oxigênio (O) e do enxofre (S), mostrando sua relação de grupo. A tabela completa exibe a organização dos elementos em períodos e grupos, demonstrando as tendências nas propriedades dos elementos ao longo da tabela. Observe como o estado físico do oxigênio, a temperatura ambiente, é diferente do enxofre.
Diferenças entre Número Atômico e Massa Atômica
Compreender as diferenças entre número atômico e massa atômica é fundamental para a química. Esses dois conceitos, embora relacionados, fornecem informações distintas sobre os átomos e os elementos químicos. O número atômico define a identidade de um elemento, enquanto a massa atômica fornece uma medida da sua massa.
Definição e Explicação
O número atômico, representado pela letra Z, é o número de prótons presentes no núcleo de um átomo. Cada elemento químico possui um número atômico único e exclusivo. Este número define a identidade do elemento e sua posição na tabela periódica. Por exemplo, o número atômico do hidrogênio é 1, indicando que cada átomo de hidrogênio possui 1 próton em seu núcleo.
A massa atômica, representada pelo símbolo A, é a média ponderada das massas dos isótopos de um elemento. É importante diferenciar massa atômica de número de massa. O número de massa é o número total de prótons e nêutrons no núcleo de um átomo específico. A massa atômica, por outro lado, é uma média ponderada, considerando a abundância relativa de cada isótopo.
Importância em Química
O número atômico é crucial para a identificação de elementos químicos. Na tabela periódica, os elementos são organizados em ordem crescente de número atômico, permitindo a fácil identificação e comparação de suas propriedades. Elementos com o mesmo número atômico compartilham as mesmas características químicas.
A massa atômica desempenha um papel fundamental em cálculos estequiométricos. Ela é utilizada para determinar a quantidade de matéria em uma reação química, permitindo prever as proporções em que os reagentes reagem e os produtos são formados. Além disso, a massa atômica influencia as propriedades físicas dos elementos, como a densidade e o ponto de fusão, pois afeta a massa dos átomos, o que afeta a interação entre eles.
Diagrama Comparativo
| Elemento | Número Atômico (Z) | Massa Atômica (u) |
|---|---|---|
| Hidrogênio (H) | 1 | 1,008 |
| Carbono (C) | 6 | 12,011 |
| Nitrogênio (N) | 7 | 14,007 |
| Oxigênio (O) | 8 | 15,999 |
| Enxofre (S) | 16 | 32,065 |
Relação com a Tabela Periódica
O número atômico determina a posição de um elemento na tabela periódica. Elementos com números atômicos consecutivos estão dispostos em sequência na tabela, refletindo as tendências periódicas em suas propriedades.
Influência nas Propriedades Físicas
A massa atômica influencia as propriedades físicas dos elementos. Elementos com massas atômicas maiores geralmente possuem pontos de fusão e ebulição mais elevados e densidades maiores. Isso ocorre porque a massa atômica maior corresponde a um maior número de partículas em um dado volume, o que leva a maior interação entre as partículas e, consequentemente, a maior força necessária para mudanças de estado.
Métodos de Obtenção do Oxigênio
O oxigênio, elemento essencial à vida, pode ser obtido por diversos métodos, cada um com suas particularidades em termos de eficiência, custo e segurança. Compreender esses métodos é crucial para o desenvolvimento de processos sustentáveis e seguros para a produção de oxigênio, tanto em escala industrial quanto em laboratório.
Métodos de Obtenção do Oxigênio: Uma Análise Comparativa
Existem diferentes abordagens para a extração do oxigênio, cada uma com vantagens e desvantagens. A escolha do método ideal depende do contexto, levando em consideração fatores como escala de produção, custo, segurança e disponibilidade de recursos.
Eletrólise da Água
A eletrólise da água é um método eficiente e relativamente limpo para a produção de oxigênio. Um processo eletroquímico, utiliza a passagem de corrente elétrica através da água, decompondo-a em seus elementos constituintes: hidrogênio e oxigênio. Este método é amplamente utilizado em laboratórios e, em menor escala, em indústrias, embora seja mais caro que outros métodos em larga escala.
- Eficácia: Boa, principalmente em aplicações laboratoriais e pequenas indústrias, devido à sua pureza.
- Custo: Geralmente mais elevado do que a separação do ar, devido à necessidade de energia elétrica. O custo varia com a escala de produção e a eficiência da instalação.
- Segurança: Relativamente segura, desde que o equipamento seja mantido em boas condições e as precauções de segurança elétrica sejam observadas. O manuseio do hidrogênio gerado também requer atenção.
Destilação Fracionada do Ar Liquefeito
Este método, amplamente utilizado na indústria, envolve a liquefação do ar atmosférico, seguido da separação dos componentes por destilação fracionada. O ar, composto principalmente de nitrogênio, oxigênio e argônio, é resfriado até a liquefação. A temperatura e pressão são cuidadosamente controladas para separar os gases em suas diferentes temperaturas de ebulição. Este método é extremamente eficiente em escala industrial, tornando-o o mais comum para a produção em massa de oxigênio.
- Eficácia: Muito alta, devido à sua escala de produção e à pureza do produto final.
- Custo: Geralmente mais baixo do que a eletrólise da água, principalmente em grande escala, devido à utilização de recursos naturais.
- Segurança: O processo envolve temperaturas e pressões elevadas, requerendo equipamentos e protocolos rigorosos de segurança, principalmente em relação à manipulação de materiais criogênicos.
Obtenção do Oxigênio por Decomposição Térmica
Alguns compostos químicos, como o dióxido de manganês (MnO 2), podem liberar oxigênio quando aquecidos. A decomposição térmica é uma técnica simples, mas limitada em termos de escala e pureza.
- Eficácia: Baixa, principalmente em comparação com os outros métodos. A pureza do oxigênio obtido pode variar.
- Custo: Geralmente baixo, mas o baixo rendimento torna-o economicamente desvantajoso em larga escala.
- Segurança: O aquecimento pode gerar riscos, especialmente em altas temperaturas. É importante o uso de equipamentos apropriados para evitar acidentes e garantir a segurança do operador.
Diagrama Simplificado dos Métodos
| Método | Descrição | Imagem/Símbolo |
|---|---|---|
| Eletrólise da Água | Separação da água em seus componentes por corrente elétrica. | (Imagine uma célula eletroquímica com eletrodos e uma fonte de corrente elétrica.) |
| Destilação Fracionada do Ar Liquefeito | Liquefação e separação dos gases do ar por suas diferentes temperaturas de ebulição. | (Imagine uma coluna de destilação com várias bandejas e diferentes temperaturas indicadas.) |
| Decomposição Térmica | Aquecimento de compostos químicos para liberação de oxigênio. | (Imagine um béquer com um composto químico sendo aquecido por um bico de Bunsen.) |
O Papel do Oxigênio em Processos Industriais
O oxigênio, elemento essencial para a vida, desempenha um papel crucial em inúmeras operações industriais. Sua utilização otimizada impacta diretamente na eficiência e nos custos de produção em diversos setores. A disponibilidade de oxigênio puro, em concentrações superiores às encontradas no ar atmosférico, permite acelerar e otimizar reações químicas, reduzindo o tempo de processamento e melhorando os resultados.O oxigênio é fundamental em processos industriais, desde a produção de aço até a queima de combustíveis.
Sua utilização controlada e estratégica impacta positivamente a produtividade e a rentabilidade de empresas de diversos setores, destacando-se sua importância na otimização de processos.
Produção de Aço
A produção de aço é um dos maiores consumidores de oxigênio em escala industrial. O uso de oxigênio puro em fornos a arco elétrico ou fornos de conversão a oxigênio (L-D) permite que a produção de aço ocorra de forma mais eficiente e com menor consumo de energia. A oxidação de impurezas, como carbono e enxofre, é acelerada pela alta concentração de oxigênio, resultando em um aço de melhor qualidade e com menor teor de impurezas.
O controle preciso do oxigênio no processo permite um controle mais rigoroso do processo, melhorando a qualidade do produto final.
Outras Aplicações Industriais
O oxigênio encontra aplicação em uma variedade de processos industriais, além da produção de aço. Seu uso otimizado impacta a eficiência e a qualidade de produtos em diferentes setores.
- Combustão: Em indústrias que utilizam combustíveis, como siderúrgicas, cimenteiras e termelétricas, o oxigênio puro permite uma combustão mais eficiente, com maior produção de energia e menor emissão de poluentes. O uso de oxigênio puro aumenta a taxa de queima, reduzindo o consumo de combustível e o tempo de produção.
- Soldagem: O oxigênio é amplamente utilizado em processos de soldagem, em conjunto com outros gases, para obter maior temperatura e eficiência no processo. O oxigênio puro proporciona um ambiente ideal para a fusão dos metais, permitindo uma soldagem mais rápida e de maior qualidade.
- Tratamento de Água: Em estações de tratamento de água, o oxigênio é utilizado para a oxidação de contaminantes, melhorando a qualidade da água e eliminando odores e sabores indesejáveis. A oxidação acelerada por oxigênio puro melhora a qualidade da água tratada.
Eficiência do Uso de Oxigênio
A eficiência do uso de oxigênio em processos industriais depende de fatores como a pureza do oxigênio utilizado, a tecnologia empregada e o controle preciso do processo. Um bom planejamento e o uso de equipamentos adequados garantem um retorno positivo em termos de produtividade e custos. A otimização do uso de oxigênio permite reduzir o consumo de combustíveis fósseis e diminuir as emissões de gases de efeito estufa.
As empresas que adotam boas práticas de uso de oxigênio podem reduzir significativamente seus custos de produção e aumentar sua competitividade no mercado.
Diagrama de Aplicações Industriais do Oxigênio, Qual O Número Atômico Do Oxigênio
| Setor Industrial | Aplicação do Oxigênio |
|---|---|
| Produção de Aço | Oxidação de impurezas nos fornos de conversão a oxigênio (L-D), melhorando a qualidade do aço. |
| Combustão | Aumento da eficiência de combustão em indústrias que utilizam combustíveis, como siderúrgicas e termelétricas. |
| Soldagem | Melhora da temperatura e eficiência em processos de soldagem, utilizando-o em conjunto com outros gases. |
| Tratamento de Água | Oxidação de contaminantes, melhorando a qualidade da água. |
Ao longo desta jornada, exploramos a fascinante história da descoberta do oxigênio, desvendamos a estrutura atômica do elemento e seus isótopos, e descobrimos suas inúmeras aplicações na indústria, na medicina e na pesquisa científica. Esperamos que você tenha apreciado esta exploração, e que tenha compreendido a importância fundamental do número atômico na compreensão dos elementos e da química. O oxigênio, com seu número atômico 8, é essencial para a vida como a conhecemos!
Qual a diferença entre número atômico e número de massa?
O número atômico indica o número de prótons no núcleo do átomo, enquanto o número de massa representa o total de prótons e nêutrons. É a soma dos prótons e nêutrons.
Quais são os isótopos estáveis do oxigênio?
Os isótopos estáveis do oxigênio são 16O, 17O e 18O. Cada um tem um número diferente de nêutrons.
Qual a importância do oxigênio na respiração celular?
O oxigênio é fundamental para a respiração celular, pois atua como o aceptor final de elétrons na cadeia respiratória, liberando energia essencial para as funções vitais.
Como o oxigênio é obtido industrialmente?
O oxigênio pode ser obtido industrialmente por meio da destilação fracionada do ar líquido, um processo que separa os componentes do ar de acordo com seus pontos de ebulição.












