Numero Atomico Oxigenio – Número Atômico Oxigênio: embarque conosco em uma jornada fascinante para desvendar os mistérios desse elemento vital! Descobriremos seu lugar na Tabela Periódica, sua estrutura atômica, isótopos e as propriedades que o tornam tão especial. Prepare-se para mergulhar em um universo de reações químicas, propriedades físicas e aplicações práticas que transformam o oxigênio em um personagem-chave na ciência e na vida cotidiana!
Vamos explorar as propriedades químicas do oxigênio, desde sua eletronegatividade até sua capacidade de formar ligações covalentes, analisando como essas características o tornam essencial na formação de compostos químicos. Além disso, desvendaremos as propriedades físicas, como estado físico, ponto de fusão e ebulição, comparando-o com outros elementos do grupo 16. Prepare-se para uma aventura química!
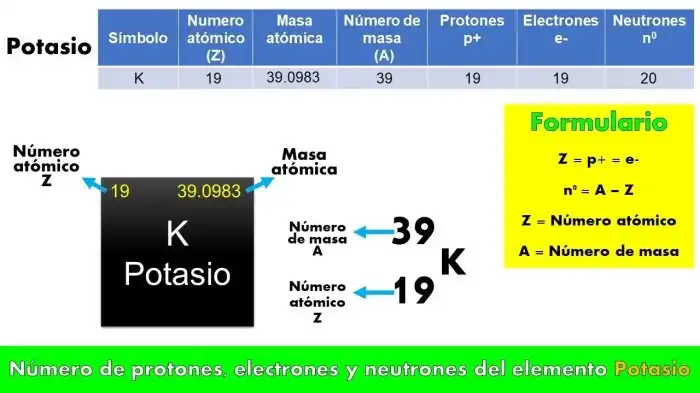
Introdução ao Número Atômico do Oxigênio
Olá, exploradores da ciência! Preparamos uma jornada fascinante pelo mundo do oxigênio, focando em seu número atômico e sua posição fundamental na tabela periódica. Preparem-se para mergulhar em detalhes intrigantes sobre esse elemento vital para a vida no nosso planeta!O número atômico de um elemento químico representa a quantidade de prótons em seu núcleo atômico. É como um número de identificação único para cada elemento, crucial para organizá-los na tabela periódica e compreender suas propriedades químicas.
O oxigênio, com seu número atômico 8, ocupa uma posição específica nessa tabela, revelando características que o distinguem de outros elementos.
O Número Atômico do Oxigênio na Tabela Periódica
O número atômico do oxigênio, 8, significa que cada átomo de oxigênio possui 8 prótons em seu núcleo. Essa informação é fundamental para entender suas reações químicas e como ele se liga a outros elementos. A posição do oxigênio na tabela periódica, no grupo 16 e no período 2, indica tendências periódicas em suas propriedades, como eletronegatividade e reatividade.
Estrutura Atômica do Oxigênio
O átomo de oxigênio, com número atômico 8, é composto por 8 prótons, 8 nêutrons (em seu isótopo mais comum) e 8 elétrons. Os elétrons orbitam o núcleo em diferentes níveis de energia, formando uma estrutura complexa que determina as propriedades químicas do elemento. A configuração eletrônica do oxigênio é 1s 22s 22p 4, demonstrando a disposição desses elétrons em camadas e subcamadas ao redor do núcleo.
Isótopos do Oxigênio
O oxigênio possui três isótopos estáveis: 16O, 17O e 18O. A variação no número de nêutrons entre esses isótopos demonstra a flexibilidade da estrutura atômica, sem alterar o número de prótons, e, portanto, sua identidade como oxigênio. A abundância relativa de cada isótopo influencia as propriedades físicas e químicas observadas em amostras naturais do elemento.
Comparação com Outros Elementos
Comparando o número atômico do oxigênio (8) com outros elementos, podemos entender sua posição relativa na tabela periódica. Elementos com números atômicos menores (como o hidrogênio, com número atômico 1) possuem estruturas atômicas mais simples, enquanto elementos com números atômicos maiores (como o urânio, com número atômico 92) exibem complexidades maiores e propriedades mais diversas.
Informações Básicas do Oxigênio
| Propriedade | Valor |
|---|---|
| Símbolo | O |
| Número Atômico | 8 |
| Massa Atômica | 15,999 u |
Propriedades Atômicas do Oxigênio

Source: vecteezy.com
O oxigênio, um elemento essencial para a vida na Terra, desempenha um papel crucial em inúmeras reações químicas e processos biológicos. Suas propriedades atômicas, tanto químicas quanto físicas, determinam seu comportamento e interações com outros elementos. Este estudo aprofundará as características fundamentais do oxigênio, analisando suas propriedades e comparando-as com outros elementos do seu grupo na tabela periódica.
Propriedades Químicas
O oxigênio demonstra uma alta eletronegatividade, o que o torna um forte agente oxidante. Essa propriedade influencia significativamente suas reações químicas, impulsionando sua tendência a receber elétrons e formar ligações. A eletronegatividade do oxigênio é uma das forças motrizes por trás de sua capacidade de formar compostos com uma ampla variedade de elementos.
- Eletronegatividade: O oxigênio possui uma alta eletronegatividade, o que o torna um aceptor de elétrons em ligações químicas. Essa característica influencia sua capacidade de formar compostos iônicos e covalentes.
- Afinidade Eletrônica: O oxigênio possui uma alta afinidade eletrônica, o que indica sua grande tendência a receber um elétron para completar sua camada de valência. Essa propriedade está diretamente relacionada à sua capacidade de formar ligações e atuar como agente oxidante.
- Potencial de Ionização: O potencial de ionização do oxigênio é moderado, indicando que ele pode perder elétrons, embora menos prontamente do que ganhá-los. Essa propriedade influencia sua capacidade de participar em certas reações químicas.
- Valência: A valência do oxigênio é geralmente 2, significando que ele geralmente forma duas ligações covalentes para atingir a estabilidade. Esta propriedade fundamental define sua capacidade de formar uma ampla gama de compostos.
- Tendência para Formar Ligações Covalentes: O oxigênio exibe uma forte tendência a formar ligações covalentes, devido à sua alta eletronegatividade. Essas ligações são cruciais na formação de moléculas orgânicas e inorgânicas.
- Formação de Ligações Duplas e Triplas: O oxigênio, apesar de sua tendência à formação de ligações simples, pode formar ligações duplas (como no dióxido de carbono, CO 2) e, em alguns casos, ligações triplas, embora menos comuns. A formação dessas ligações mais complexas resulta em diferentes estruturas moleculares e propriedades.
- Hibridização: A hibridização do oxigênio nas ligações químicas influencia a geometria molecular e as propriedades dos compostos formados. Por exemplo, na água (H 2O), o oxigênio apresenta hibridização sp 3, resultando em uma estrutura angular.
Reações Químicas Comuns
O oxigênio participa em diversas reações químicas, incluindo reações de combustão, oxidação e reações com metais e não-metais. A sua alta reatividade é fundamental em processos naturais e industriais.
- Combustão: O oxigênio é um componente essencial em reações de combustão. A combustão de metano (CH 4), por exemplo, produz dióxido de carbono (CO 2) e água (H 2O) como produtos principais. A reação exige calor para iniciar a combustão.
- Oxidação: O oxigênio atua como um agente oxidante em diversas reações de oxidação, onde promove a perda de elétrons por outros elementos. A oxidação de metais, como o sódio (Na), resulta na formação de óxidos. Por exemplo, a reação do oxigênio com o sódio (2Na + O 2 → Na 2O) produz óxido de sódio, um composto iônico.
- Reações com Metais e Não-Metais: O oxigênio reage com metais e não-metais para formar óxidos. A reação com metais, como o ferro (Fe), leva à formação de óxido de ferro (Fe 2O 3), um composto sólido. A reação com não-metais, como o enxofre (S), gera óxidos de enxofre, que podem ser gases ou sólidos.
Propriedades Físicas
As propriedades físicas do oxigênio influenciam seu estado e comportamento em diferentes condições.
- Estado Físico: O oxigênio é um gás incolor, inodoro e insípido em condições ambientes.
- Ponto de Fusão: O ponto de fusão do oxigênio é -218,4 °C.
- Ponto de Ebulição: O ponto de ebulição do oxigênio é -182,96 °C.
- Densidade: A densidade do oxigênio é menor que a do ar.
- Solubilidade em Água: O oxigênio é pouco solúvel em água, mas é essencial para a vida aquática.
- Condutividade Térmica e Elétrica: O oxigênio é um mau condutor de calor e eletricidade.
Comparação com Outros Elementos do Grupo
As propriedades do oxigênio se relacionam com as dos outros elementos do grupo 16 (calcogênios).
- Semelhanças e Diferenças: O oxigênio compartilha semelhanças químicas e físicas com os outros calcogênios, como enxofre, selênio, telúrio e polônio. As diferenças residem nas tendências periódicas, como aumento do raio atômico e diminuição da eletronegatividade ao descer o grupo. Essas diferenças refletem a estrutura atômica e o comportamento eletrônico dos diferentes elementos.
Ligação Química
O oxigênio forma ligações covalentes, iônicas e, em menor medida, ligações metálicas com outros elementos.
- Tipos de Ligações: O oxigênio forma principalmente ligações covalentes, onde compartilha elétrons com outros átomos. Também pode formar ligações iônicas, como nos óxidos metálicos. Em alguns casos específicos, o oxigênio pode participar de ligações metálicas, mas essa ocorrência é menos comum.
- Exemplos de Ligações: Na água (H 2O), o oxigênio forma ligações covalentes com os átomos de hidrogênio. Nos óxidos metálicos, como o óxido de sódio (Na 2O), o oxigênio forma ligações iônicas com os íons metálicos.
Tabela HTML
| Propriedade | Valor/Descrição | Unidade |
|---|---|---|
| Estado físico (25°C) | Gás | – |
| Ponto de fusão | -218.4 | °C |
| Ponto de ebulição | -182.96 | °C |
| Densidade (0°C, 1 atm) | 1.429 g/L | g/L |
| Solubilidade em água (20°C) | 7.36 mg/L | mg/L |
| Eletronegatividade | 3.44 | – |
| Afinidade eletrônica | 141 kJ/mol | kJ/mol |
Aplicações do Oxigênio
Source: com.ar
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras aplicações, desde as indústrias até os procedimentos médicos. Sua capacidade de sustentar a combustão e reagir com outros elementos o tornam um elemento versátil e essencial. Vamos explorar as diversas maneiras como o oxigênio impacta nossas vidas.
Aplicações Industriais do Oxigênio
O oxigênio é um componente essencial em diversas indústrias. Sua utilização em processos de produção, como a siderurgia e a metalurgia, permite obter metais com maior pureza e qualidade. A combustão controlada, utilizando oxigênio em concentrações elevadas, aumenta a eficiência e a velocidade dos processos.
- Produção de Aço: O oxigênio é utilizado nos altos-fornos para oxidar impurezas e acelerar o processo de produção de aço. Essa técnica melhora a qualidade do produto final, reduzindo o tempo e os custos de produção.
- Soldagem: O oxigênio, combinado com outros gases como o acetileno, é utilizado na soldagem de metais. A alta concentração de oxigênio permite temperaturas elevadas para fundir os metais e garantir uma união firme e duradoura.
- Fabricação de Produtos Químicos: Diversos produtos químicos dependem do oxigênio em suas etapas de produção. Por exemplo, a síntese de metanol e a oxidação de compostos orgânicos necessitam do oxigênio para reagir e gerar os produtos desejados.
Aplicações Médicas do Oxigênio
O oxigênio é vital para a respiração humana. Em situações de emergência, ou para pacientes com dificuldades respiratórias, o oxigênio é um recurso fundamental. Sua administração adequada garante que os tecidos recebam o oxigênio necessário para o funcionamento correto do organismo.
- Tratamento de Doenças Respiratórias: Pacientes com asma, enfisema ou outras doenças pulmonares frequentemente necessitam de terapia com oxigênio para melhorar sua capacidade respiratória e suprir a demanda por oxigênio do organismo. A administração de oxigênio em concentrações controladas melhora o bem-estar e reduz o estresse no sistema respiratório.
- Cirurgias e Procedimentos Médicos: Em procedimentos cirúrgicos, a administração de oxigênio suplementar ajuda a manter os níveis adequados de oxigênio no sangue dos pacientes, evitando complicações e promovendo a recuperação. O oxigênio também é fundamental para pacientes que sofrem de dificuldades respiratórias em decorrência de acidentes ou traumas.
- Cuidados Paliativos: Pacientes em fase terminal de doenças graves podem necessitar de oxigênio para aliviar os sintomas e melhorar a qualidade de vida. A administração adequada do oxigênio pode auxiliar no alívio da falta de ar e na melhora do bem-estar geral.
Importância do Oxigênio para a Respiração
A respiração é um processo essencial para a vida. O oxigênio é o elemento fundamental para a respiração aeróbica, um processo que libera energia dos alimentos. Sem o oxigênio, o corpo não conseguiria gerar energia suficiente para manter suas funções vitais.
Importância do Oxigênio na Combustão
O oxigênio é fundamental para a combustão. A combustão é uma reação química rápida que libera energia na forma de calor e luz.
A presença do oxigênio é necessária para que a reação ocorra. Diversas aplicações industriais, como a geração de energia em usinas termoelétricas e a queima de combustíveis em veículos, dependem da combustão e, consequentemente, do oxigênio.
Comparação com Outros Elementos
Comparando o oxigênio com outros elementos, nota-se sua importância única para a vida. Enquanto outros elementos podem desempenhar papéis importantes em reações químicas, o oxigênio é essencial para a respiração e a combustão. A capacidade de reagir com diversos outros elementos confere ao oxigênio uma versatilidade sem precedentes em aplicações diversas.
Tabela de Usos do Oxigênio
| Área | Uso |
|---|---|
| Industrial | Produção de aço, soldagem, fabricação de produtos químicos |
| Médica | Tratamento de doenças respiratórias, cirurgias, cuidados paliativos |
| Respiração | Essencial para o processo de respiração aeróbica |
| Combustão | Reagente fundamental para processos de combustão |
História e Descoberta do Oxigênio
A busca pelo entendimento da composição do ar, um mistério que intrigou mentes brilhantes por séculos, culminou na descoberta crucial do oxigênio. Essa jornada científica, repleta de experimentos e teorias divergentes, nos revela a importância da observação, da experimentação e da persistência na ciência. Vamos mergulhar na história fascinante dessa descoberta, explorando as mentes curiosas que desvendaram os segredos do elemento vital para a vida.A compreensão da composição do ar evoluiu ao longo do tempo, passando por diferentes teorias e experimentos.
Cientistas de diversas épocas contribuíram para o conhecimento que temos hoje sobre o oxigênio, revelando a complexidade e a beleza da ciência por trás de um elemento tão essencial.
Primeiras Teorias Sobre a Composição do Ar
As teorias sobre a composição do ar antes da descoberta do oxigênio eram variadas e, em muitos casos, incorretas. A ideia predominante era a de que o ar era uma substância simples e inalterável. Entretanto, algumas observações, como a combustão, a respiração e a putrefação, sugeriam a presença de componentes distintos no ar. Por exemplo, os filósofos gregos acreditavam que o ar era uma mistura de diferentes elementos, mas sem a comprovação científica.
Os Precursores da Descoberta do Oxigênio
A descoberta do oxigênio não surgiu do nada, mas sim de um esforço coletivo de cientistas que, com suas observações e experimentos, se aproximaram gradualmente da compreensão desse elemento. Diversos pesquisadores, em diferentes épocas e culturas, contribuíram para o conhecimento que culminou na descoberta definitiva. Dentre eles, destacamos os cientistas que realizaram trabalhos cruciais no processo.
Cientistas Importantes na Descoberta do Oxigênio
Diversos cientistas desempenharam papéis fundamentais na elucidação da natureza do oxigênio. Suas contribuições, baseadas em observações e experimentos cuidadosos, foram cruciais para a compreensão moderna do elemento. Vamos conhecer alguns deles:
- Robert Boyle (1627-1691): Realizou experimentos com o ar comprimido e expandido, demonstrando que o ar era um fator crucial na combustão. Suas observações foram fundamentais para a compreensão das reações químicas e dos processos envolvidos na queima. Seus estudos lançaram as bases para a compreensão dos gases e a composição do ar.
- Joseph Priestley (1733-1804): Em 1774, ele isolou o oxigênio pela primeira vez, embora não tenha reconhecido sua natureza como um elemento distinto. Priestley observou que o ar era modificado após determinadas reações químicas, e esse foi um passo crucial na direção da descoberta. Ele observou a combustão de substâncias em um ambiente específico, produzindo um gás que sustentava a combustão mais intensamente do que o ar comum.
- Antoine Lavoisier (1743-1794): Reconhecido como o descobridor do oxigênio, Lavoisier compreendeu a importância do oxigênio na combustão e na respiração. Ele realizou experimentos cuidadosos, mostrando que o ar era uma mistura de gases, e o oxigênio era um componente essencial. Suas pesquisas revolucionaram a química, demonstrando que a combustão envolvia a combinação do material com o oxigênio do ar.
Principais Descobertas e Teorias
As teorias sobre a composição do ar evoluíram com o tempo, passando de visões filosóficas para explicações baseadas em experimentos e observações. A compreensão científica do ar passou por uma transformação significativa.
“A combustão não é uma simples perda de matéria, mas sim uma combinação com o ar.”
Antoine Lavoisier
“Observando a combustão de uma substância num tipo específico de ar, eu descobri um gás que permitia a combustão com maior intensidade do que o ar normal.”
Joseph Priestley
Linha do Tempo das Descobertas do Oxigênio
| Data | Evento | Cientista(s) |
|---|---|---|
| 1774 | Isolamento do oxigênio | Joseph Priestley |
| 1775 | Experimentos e observações sobre a combustão e a respiração | Antoine Lavoisier |
| 1777 | Demonstração de que o oxigênio é um elemento químico | Antoine Lavoisier |
| 1778 | Reconhecimento do papel do oxigênio na respiração | Antoine Lavoisier |
Isótopos do Oxigênio
O oxigênio, elemento essencial para a vida, possui diferentes versões atômicas, chamadas isótopos. Esses isótopos, apesar de terem o mesmo número de prótons e elétrons, diferem no número de nêutrons, o que afeta suas massas e, consequentemente, suas propriedades. Compreender os isótopos do oxigênio é fundamental para diversos campos da ciência e da tecnologia.
Características dos Isótopos Estáveis
Os isótopos estáveis do oxigênio são ¹⁶O, ¹⁷O e ¹⁸O. A estabilidade indica que esses isótopos não sofrem decaimento radioativo em um tempo observável. Outros isótopos do oxigênio existem, mas são radioativos e têm tempos de meia-vida muito curtos.
Propriedades dos Isótopos Estáveis
- Cada isótopo possui um número específico de nêutrons, que define sua massa atômica. A variação no número de nêutrons afeta as propriedades físicas e químicas dos isótopos, embora suas propriedades químicas sejam muito semelhantes.
- O número atômico do oxigênio é 8, significando que todos os seus isótopos possuem 8 prótons. Este número define o elemento químico.
- O número de massa de um isótopo representa o número total de prótons e nêutrons no núcleo atômico. A diferença no número de massa entre os isótopos resulta em diferentes massas atômicas.
Tabela de Isótopos Estáveis do Oxigênio
| Isótopo | Número Atômico | Número de Massa | Número de Prótons | Número de Nêutrons | Massa Atômica (u) | Configuração Eletrônica |
|---|---|---|---|---|---|---|
| ¹⁶O | 8 | 16 | 8 | 8 | 15,9949 u | 1s²2s²2p⁴ |
| ¹⁷O | 8 | 17 | 8 | 9 | 16,9991 u | 1s²2s²2p⁴ |
| ¹⁸O | 8 | 18 | 8 | 10 | 17,9991 u | 1s²2s²2p⁴ |
Abundância Relativa
A abundância natural dos isótopos estáveis do oxigênio é a seguinte: ¹⁶O (99,762%), ¹⁷O (0,038%) e ¹⁸O (0,200%). Essa distribuição influencia a massa atômica média do oxigênio, que é utilizada em cálculos químicos.
Aplicações dos Isótopos
Embora os isótopos do oxigênio não possuam aplicações específicas individualmente, sua presença em diferentes compostos e processos naturais é crucial. Por exemplo, a água contendo isótopos diferentes de oxigênio é utilizada em estudos isotópicos para entender processos naturais como a formação de rochas e a circulação oceânica.
Importância na Ciência e na Vida Cotidiana
Os isótopos do oxigênio desempenham um papel fundamental na ciência e na vida cotidiana, apesar de não terem aplicações individuais amplamente conhecidas. Sua abundância relativa na água, por exemplo, influencia as propriedades físicas da água e é crucial para a manutenção da vida em nosso planeta. A análise isotópica de amostras de água pode revelar informações valiosas sobre processos naturais, como a formação de rochas e a circulação oceânica.
Essas informações são úteis para entender melhor o nosso planeta e prever mudanças climáticas.
Ligações Químicas do Oxigênio
O oxigênio, um elemento vital para a vida, exibe uma ampla gama de ligações químicas, impulsionando uma variedade de reações e processos. Suas propriedades de ligação são fundamentais para entender sua participação em moléculas essenciais, desde a água até o ar que respiramos. Compreender essas ligações é crucial para desvendar sua influência em diferentes sistemas químicos e biológicos.
Tipos de Ligações Químicas do Oxigênio
O oxigênio, com sua alta eletronegatividade, forma predominantemente ligações covalentes. Essas ligações resultam do compartilhamento de elétrons entre átomos de oxigênio e outros elementos. A formação de ligações covalentes ocorre quando a diferença de eletronegatividade entre os átomos envolvidos é relativamente baixa, permitindo que ambos os átomos atraiam os elétrons compartilhados. Além disso, o oxigênio também pode participar de ligações iônicas em alguns compostos, como óxidos metálicos, onde há uma transferência completa de elétrons para formar íons.
Formação da Ligação Covalente no Oxigênio
A ligação covalente entre dois átomos de oxigênio para formar a molécula O 2 é um exemplo clássico. A estrutura eletrônica do oxigênio (8 elétrons, com 6 elétrons na camada de valência) leva ao compartilhamento de dois pares de elétrons (uma ligação dupla). A ligação covalente entre os átomos de oxigênio envolve a formação de uma ligação sigma (σ) e uma ligação pi (π), resultando em uma molécula com geometria linear.
A ligação sigma resulta da sobreposição de orbitais atômicos ao longo do eixo internuclear, enquanto a ligação pi resulta da sobreposição lateral dos orbitais atômicos.
Propriedades das Ligações Químicas do Oxigênio
As propriedades das ligações químicas do oxigênio são cruciais para entender suas reações e aplicações. As energias de ligação, comprimentos de ligação e ângulos de ligação são fatores determinantes na estabilidade e comportamento das moléculas. A ligação covalente O-O na molécula O 2 tem uma energia de ligação de aproximadamente 498 kJ/mol, e o comprimento de ligação é de aproximadamente 121 pm.
A polaridade das ligações covalentes do oxigênio é determinada pela diferença de eletronegatividade entre os átomos participantes. Em moléculas como a água (H 2O), a ligação O-H é polar devido à maior eletronegatividade do oxigênio em relação ao hidrogênio.
Comparação com Outros Elementos
Comparando o oxigênio com outros elementos como carbono, nitrogênio, flúor, hidrogênio e enxofre, nota-se que a eletronegatividade do oxigênio é um fator chave para a formação de ligações polares e covalentes. O oxigênio apresenta uma eletronegatividade intermediária entre o flúor (o mais eletronegativo) e o carbono (menos eletronegativo). A alta eletronegatividade do oxigênio, combinada com sua capacidade de formar múltiplas ligações, o torna um elemento versátil na formação de moléculas complexas.
Diagramas de Ligações Químicas
- Água (H2O): Uma molécula de água apresenta dois átomos de hidrogênio ligados covalentemente a um átomo de oxigênio. A geometria molecular é angular, com um ângulo de ligação H-O-H de aproximadamente 104,5°. A ligação O-H é polar devido à diferença de eletronegatividade.
- Dióxido de Carbono (CO2): O dióxido de carbono apresenta dois átomos de oxigênio ligados covalentemente a um átomo de carbono. A geometria molecular é linear, com um ângulo de ligação O-C-O de 180°. As ligações C=O são polares.
- Dióxido de Enxofre (SO2): O dióxido de enxofre apresenta dois átomos de oxigênio ligados covalentemente a um átomo de enxofre. A geometria molecular é angular, com um ângulo de ligação de aproximadamente 119,5°. As ligações S=O são polares.
Geometrias Moleculares
As geometrias moleculares dos compostos do oxigênio são determinadas pela disposição espacial dos átomos em torno do átomo central de oxigênio. As geometrias incluem linear, angular, tetraédrica, trigonal plana, dentre outras. A estrutura eletrônica e os ângulos de ligação influenciam a geometria molecular.
Tabela HTML
| Tipo de Ligação | Exemplo de Composto | Estrutura de Lewis | Geometria Molecular |
|---|---|---|---|
| Covalente | O2 | [Desenho da estrutura de Lewis de O2] | Linear |
| Covalente | H2O | [Desenho da estrutura de Lewis de H2O] | Angular |
| Covalente | CO2 | [Desenho da estrutura de Lewis de CO2] | Linear |
Importância das Ligações Químicas do Oxigênio
As ligações químicas do oxigênio desempenham um papel fundamental na química e na vida. A capacidade do oxigênio de formar ligações covalentes, em particular, permite a formação de moléculas essenciais para a vida, como a água, que é o solvente universal dos sistemas biológicos. Além disso, a ligação covalente é crucial para a respiração celular, onde o oxigênio é consumido para liberar energia dos alimentos.
A versatilidade das ligações químicas do oxigênio o torna um componente essencial em diversos processos químicos, impulsionando uma ampla gama de reações.
O Oxigênio na Natureza
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em diversos ambientes naturais. Sua presença na atmosfera, na água e em outros ecossistemas influencia diretamente a biodiversidade e os processos vitais. Compreender sua distribuição e importância em diferentes cenários é essencial para a preservação ambiental.
Presença na Atmosfera
A atmosfera terrestre é composta principalmente por nitrogênio (78%) e oxigênio (21%). A concentração atual de oxigênio é vital para a manutenção da vida aeróbica, permitindo a respiração de animais e a combustão. Ao longo da história geológica, a proporção de oxigênio na atmosfera variou significativamente. Estudos indicam que, em épocas passadas, a concentração de oxigênio era muito menor, impactando a fauna e flora da época.
A fotossíntese, realizada por organismos fotossintetizantes, é a principal responsável pela manutenção dos níveis atuais de oxigênio. A continuidade deste processo é essencial para o equilíbrio ambiental.
Presença na Água
O oxigênio também é essencial para a vida aquática. A solubilidade do oxigênio na água, no entanto, é afetada por diversos fatores, como temperatura, salinidade e profundidade. Águas mais frias geralmente conseguem dissolver mais oxigênio que águas mais quentes. A presença de sais em solução, como no caso da água do mar, diminui a capacidade de solubilidade do oxigênio.
A profundidade também influencia, com águas mais profundas apresentando menor concentração de oxigênio dissolvido. A quantidade de oxigênio dissolvido (OD) é crucial para a sobrevivência de organismos aquáticos, pois eles necessitam do oxigênio para a respiração.
Comparação de Concentrações
A concentração de oxigênio varia significativamente em diferentes ambientes. Em florestas, a presença de vegetação fotossintetizante contribui para níveis mais altos de oxigênio. Nos oceanos, a solubilidade e a circulação das águas determinam a concentração de oxigênio dissolvido. Em desertos, a menor biomassa vegetal resulta em menores níveis de oxigênio. Em altitudes elevadas, a menor pressão atmosférica afeta a concentração de oxigênio disponível.
Uma tabela pode ilustrar essas variações.
| Ambiente | Concentração de Oxigênio (aproximada) | Observações |
|---|---|---|
| Floresta | >20% | Alta densidade de vegetação fotossintetizante. |
| Oceanos | Variável, dependendo da profundidade e temperatura. | A circulação oceânica influencia a distribuição. |
| Desertos | ≈21% (em ar atmosférico) | Baixa densidade de vegetação. |
| Montanhas | ≈21% (em ar atmosférico) | Pressão atmosférica reduzida, mas concentração não varia bruscamente. |
Diagrama HTML do Ciclo do Oxigênio
O ciclo do oxigênio envolve diversos processos naturais interconectados. A fotossíntese, a respiração e a decomposição são exemplos cruciais.
Um diagrama interativo, utilizando elementos HTML como tabelas e imagens, pode facilitar a visualização desses processos.
Observação: O diagrama HTML completo não pode ser inserido aqui. Entretanto, ele mostraria, de forma clara, o ciclo do oxigênio e suas etapas, como a fotossíntese, a respiração, a decomposição e a liberação de oxigênio para a atmosfera.
Papel na Fotossíntese
A fotossíntese é um processo fundamental para a produção de oxigênio na atmosfera. Organismos fotossintetizantes, como plantas e algas, utilizam a energia da luz solar para converter dióxido de carbono e água em açúcares e oxigênio.
CO2 + H 2O + luz → C 6H 12O 6 + O 2
Este processo é essencial para o equilíbrio ambiental e a manutenção da vida na Terra.
Respiração Aeróbica
A respiração aeróbica é um processo fundamental para a obtenção de energia pelas células. Neste processo, o oxigênio atua como aceptor final de elétrons, permitindo a degradação de moléculas orgânicas e a liberação de energia. A respiração celular ocorre em várias etapas, envolvendo reações químicas complexas, que utilizam o oxigênio.
Ocorrência e Extração do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, está presente em diversas formas e desempenha papéis cruciais em inúmeros processos biológicos e industriais. Compreender sua ocorrência e os métodos de extração é essencial para apreciar sua importância e os desafios envolvidos em sua produção.
Ocorrência do Oxigênio
O oxigênio é o elemento mais abundante na crosta terrestre e na atmosfera. A forma mais comum é o oxigênio molecular (O 2), representando cerca de 21% do ar que respiramos. Também está presente na água (H 2O) e em uma vasta gama de compostos químicos, como dióxido de carbono (CO 2) e óxidos metálicos. A importância do oxigênio para a vida reside em sua função essencial na respiração aeróbica, processo crucial para a geração de energia em muitos organismos.
O ozônio (O 3), uma forma alotrópica do oxigênio, é encontrado na estratosfera, onde absorve a radiação ultravioleta do sol, protegendo a vida na superfície da Terra.
Métodos de Extração do Oxigênio
Existem vários métodos para a extração do oxigênio, cada um com suas próprias características em termos de eficiência, sustentabilidade e escala de produção. Os métodos mais comuns incluem a criogenia, a eletrólise da água e a separação por membranas.
Detalhamento dos Métodos de Extração
- Criogenia: Este método se baseia na liquefação do ar atmosférico, seguida da destilação fracionada. As diferentes substâncias presentes no ar, incluindo o oxigênio, têm pontos de ebulição distintos. O ar comprimido e resfriado é então separado em seus componentes por meio de sucessivas etapas de liquefação e destilação. Este processo é energeticamente intensivo, mas permite a produção de grandes quantidades de oxigênio.
- Eletrólise da Água: A eletrólise da água envolve a decomposição da água em seus elementos constituintes, oxigênio e hidrogênio, por meio de uma corrente elétrica. Esta reação química ocorre em eletrodos imersos na água, onde o oxigênio é liberado em um dos eletrodos. A eletrólise da água tem um potencial significativo para ser um método sustentável se a energia elétrica utilizada for proveniente de fontes renováveis.
- Separação por Membranas: Este método utiliza membranas seletivas que permitem a passagem do oxigênio, enquanto retêm outros gases. O ar é passado através dessas membranas, permitindo a separação do oxigênio. A eficiência e a escala de produção deste método ainda são relativamente menores comparadas aos outros métodos.
Comparação dos Métodos de Extração
A tabela a seguir resume as principais características dos métodos de extração do oxigênio, permitindo uma comparação direta:
| Método | Princípio | Eficiência | Sustentabilidade | Escala de Produção |
|---|---|---|---|---|
| Criogenia | Liquefação e destilação fracionada | Alta | Moderada (Energia intensiva) | Grande |
| Eletrólise da Água | Reação eletroquímica | Média | Alta (Potencialmente sustentável com energia renovável) | Variável |
| Separação por Membranas | Diferença de permeabilidade | Média | Alta | Pequena/Média |
Produção de Oxigênio
A tabela abaixo apresenta uma visão geral dos métodos de produção de oxigênio, incluindo a matéria-prima, o processo e as aplicações:
| Método | Matéria-prima | Processo | Aplicações |
|---|---|---|---|
| Criogenia | Ar atmosférico | Liquefação e destilação fracionada | Indústria metalúrgica, soldagem, produção de aço |
| Eletrólise da Água | Água | Decomposição eletroquímica | Respiração assistida, medicina, indústrias químicas |
| Separação por Membranas | Ar atmosférico | Difusão seletiva através de membranas | Aplicações em pequena escala, como laboratórios e indústrias específicas |
Importância da Produção de Oxigênio
O oxigênio é essencial em diversas aplicações industriais e médicas. Na indústria, é utilizado em processos como a metalurgia, soldagem e na produção de aço. Na medicina, é crucial para a respiração assistida, tratamento de pacientes com problemas respiratórios e em procedimentos cirúrgicos. A produção de oxigênio desempenha um papel estratégico na saúde pública e no desenvolvimento econômico.
Segurança envolvendo o Oxigênio: Numero Atomico Oxigenio
O oxigênio, essencial à vida, apresenta riscos quando manuseado incorretamente. Este guia aborda as precauções e medidas de segurança cruciais para o trabalho com oxigênio, garantindo a segurança dos profissionais e minimizando os potenciais perigos. Compreender os riscos associados, as medidas preventivas e o uso correto dos equipamentos são fundamentais para um ambiente de trabalho seguro.
Riscos Associados ao Uso de Oxigênio
O oxigênio, apesar de vital, é um oxidante poderoso. Seu manuseio inadequado pode levar a consequências graves, incluindo explosões, incêndios e asfixia. A combinação do oxigênio com materiais combustíveis cria um ambiente altamente inflamável. Pressões elevadas em cilindros de oxigênio também representam um risco, podendo resultar em acidentes se não forem manuseados com cuidado. A presença de conexões elétricas inseguras ou equipamentos com vazamentos introduzem mais perigos em áreas onde o oxigênio é usado.
Precauções de Segurança para o Manuseio de Oxigênio
Medidas de segurança rigorosas são essenciais para o manuseio seguro de cilindros de oxigênio, equipamentos e áreas de trabalho. Os cilindros devem ser armazenados em áreas bem ventiladas, afastados de materiais combustíveis. É fundamental a inspeção regular dos cilindros e conexões, buscando vazamentos ou danos. O uso de equipamentos com aterramento adequado é crucial para evitar riscos de curto-circuito.
A existência de procedimentos claros para lidar com vazamentos é essencial. O treinamento adequado para o manuseio seguro de oxigênio deve ser fornecido a todos os profissionais envolvidos. Seguindo esses procedimentos, a segurança é maximizada.
Medidas de Prevenção de Incêndios Envolvendo Oxigênio
A alta capacidade oxidante do oxigênio torna a prevenção de incêndios uma prioridade absoluta. Materiais combustíveis devem ser mantidos afastados de áreas onde o oxigênio é armazenado ou utilizado. O uso de extintores adequados, como os de gás carbônico ou pó químico seco, é fundamental para controlar incêndios em áreas com oxigênio. É crucial estabelecer procedimentos de evacuação em caso de incêndio, incluindo a definição de pontos de encontro seguros.
A rápida resposta e a execução de procedimentos de segurança previamente treinados reduzem significativamente os riscos de incidentes.
Comparativo de Riscos e Benefícios do Uso de Oxigênio
O uso de oxigênio apresenta benefícios significativos em diversas áreas, como a medicina e a indústria. Entretanto, a presença de riscos potenciais exige um equilíbrio entre os benefícios e as precauções. Na medicina, o oxigênio é vital para pacientes com dificuldades respiratórias, mas o seu manuseio inadequado pode causar problemas. Na indústria, o oxigênio é usado na soldagem e corte, proporcionando alta eficiência, mas a presença de combustíveis e conexões elétricas inseguras pode levar a incêndios ou explosões.
Minimizar os riscos requer a aplicação rigorosa das precauções de segurança.
Demonstração do Uso Correto de Equipamentos de Segurança
O uso correto dos equipamentos de segurança é essencial para garantir a proteção dos profissionais. Cilindros de oxigênio devem ser manipulados com cuidado, utilizando as válvulas e mangueiras adequadas. As máscaras de oxigênio devem ser ajustadas corretamente, seguindo as instruções do fabricante, e sua manutenção deve ser regular. A imagem de um profissional utilizando a máscara de oxigênio corretamente, contrastando com a imagem de um profissional utilizando-a de forma incorreta, demonstra a importância do treinamento e da atenção aos detalhes.
Reações do Oxigênio com Outros Elementos

Source: com.br
O oxigênio, um elemento fundamental na química, demonstra uma notável capacidade de reagir com uma vasta gama de outros elementos. Essas reações, que envolvem a formação de ligações químicas, são cruciais para compreendermos a química orgânica e inorgânica, bem como processos naturais e industriais. O oxigênio é um agente oxidante poderoso, levando à formação de uma variedade de compostos, alguns essenciais para a vida, outros cruciais para a indústria.Essas reações são o cerne de inúmeras transformações químicas, desde a combustão até a respiração celular.
A compreensão dos mecanismos e produtos dessas reações é vital para o avanço científico e tecnológico, e permite prever e controlar essas reações para aplicações práticas.
Reações do Oxigênio com Metais
O oxigênio, um não-metal, reage com diversos metais, formando óxidos. A reatividade varia significativamente dependendo do metal. Metais alcalinos, como sódio e potássio, reagem vigorosamente com o oxigênio, frequentemente em temperaturas ambiente, formando óxidos. Metais de transição, como o ferro e o cobre, reagem mais lentamente, necessitando de condições específicas. A formação de óxidos metálicos pode variar de óxidos básicos a anfóteros, dependendo da composição e estrutura do metal.
Reações do Oxigênio com Não-Metais
O oxigênio também reage com diversos não-metais, como o carbono, o enxofre e o fósforo. Essas reações podem resultar em uma ampla gama de produtos, incluindo dióxido de carbono (CO 2), dióxido de enxofre (SO 2) e pentóxido de fósforo (P 2O 5). A velocidade e o vigor dessas reações também dependem da natureza do não-metal. Reações com enxofre, por exemplo, podem produzir gases irritantes, enquanto reações com carbono, dependendo da disponibilidade de oxigênio, podem gerar monóxido de carbono (CO) ou dióxido de carbono (CO 2).
Tabela de Exemplos de Reações
| Reagente 1 | Reagente 2 | Produto | Condições |
|---|---|---|---|
| Metano (CH4) | Oxigênio (O2) | Dióxido de Carbono (CO2) e Água (H2O) | Presença de uma fonte de ignição |
| Ferro (Fe) | Oxigênio (O2) | Óxido de Ferro (Fe2O3) | Temperatura elevada |
| Enxofre (S) | Oxigênio (O2) | Dióxido de Enxofre (SO2) | Temperatura elevada |
Comparação de Reatividade
A reatividade do oxigênio varia em relação a outros elementos. Elementos como o flúor são mais reativos, enquanto outros elementos, como o hélio, praticamente não reagem com o oxigênio. A reatividade depende de fatores como a eletronegatividade dos elementos envolvidos e a energia necessária para formar novas ligações. A tendência de ganhar elétrons, ou seja, o caráter oxidante do oxigênio, é uma das razões por trás de sua reatividade com outros elementos.
Formação de Óxidos
A formação de óxidos é um dos resultados mais comuns das reações do oxigênio com outros elementos. Um óxido é um composto binário formado a partir da combinação de um elemento com oxigênio. A fórmula geral para um óxido é EO x, onde E representa o elemento e x o número de átomos de oxigênio. A natureza do óxido formado (básico, ácido ou anfótero) depende da natureza do elemento com o qual o oxigênio reage.
Importância das Reações
Essas reações são fundamentais em diversos processos químicos, biológicos e industriais. A combustão, por exemplo, é uma reação rápida de oxidação que libera calor e luz. A respiração celular, processo fundamental para a vida, também envolve reações de oxidação com o oxigênio. Além disso, a produção de energia em usinas termoelétricas, a síntese de diversos compostos químicos e a própria formação de minerais dependem de reações do oxigênio.
Aplicações Específicas do Oxigênio em Diversas Áreas
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras aplicações industriais e científicas. Sua capacidade de oxidar materiais e liberar energia o torna um agente poderoso e versátil, com aplicações que vão desde a respiração artificial até a produção de aço. Neste tópico, mergulharemos nas aplicações específicas do oxigênio em diferentes setores, explorando os processos envolvidos, a eficácia e os equipamentos utilizados.
Aplicações na Medicina
O oxigênio é essencial na medicina moderna, sendo um gás vital para o suporte à vida. Sua administração em pacientes com dificuldades respiratórias, seja por doenças ou em procedimentos cirúrgicos, garante o adequado fornecimento de oxigênio para os tecidos, evitando danos celulares e a hipóxia. A terapia com oxigênio é aplicada em diversos cenários, desde salas de cirurgia até unidades de terapia intensiva.
Equipamentos como cilindros de oxigênio, máscaras faciais e respiradores artificiais são amplamente utilizados para administrar o gás aos pacientes. A eficácia da terapia varia de acordo com a gravidade da condição do paciente e o tipo de equipamento utilizado. A administração precisa e controlada do oxigênio é crucial para garantir resultados positivos e minimizar riscos.
Aplicações na Metalurgia
Na metalurgia, o oxigênio desempenha um papel fundamental na produção de aço. O processo de conversão Bessemer, por exemplo, utiliza oxigênio para oxidar impurezas como carbono e silício no aço líquido, melhorando sua qualidade e reduzindo os custos. A injeção de oxigênio em fornos de arco elétrico também acelera o processo de fusão e permite a produção de aços mais resistentes e com propriedades desejáveis.
A eficácia do oxigênio na metalurgia está diretamente relacionada à pureza e controle da atmosfera do forno. A utilização de sistemas de injeção de oxigênio precisos é essencial para garantir a qualidade do produto final. Equipamentos como injetores de oxigênio e sistemas de monitoramento da atmosfera do forno são fundamentais.
Aplicações na Indústria Química
O oxigênio é utilizado em diversas reações químicas, como na produção de metanol e outros compostos orgânicos. Em alguns casos, o oxigênio é o reagente principal, enquanto em outros, é utilizado para controlar a atmosfera, evitando a presença de outros gases. A eficácia do oxigênio em cada reação depende das condições específicas, como temperatura, pressão e catalisadores presentes.
Os equipamentos utilizados incluem tanques de oxigênio, sistemas de controle de fluxo e equipamentos de segurança. A indústria química utiliza o oxigênio em escala industrial, e a sua eficácia é crucial para a produtividade e a qualidade dos produtos.
Aplicações na Agricultura
O oxigênio é essencial para o desenvolvimento das plantas. A utilização de sistemas de irrigação que garantem a oxigenação adequada do solo, por exemplo, pode melhorar significativamente a produtividade agrícola. Em algumas culturas, a administração de oxigênio em sistemas de armazenamento de grãos ajuda a evitar o crescimento de microrganismos e a deterioração do produto. A eficácia do oxigênio na agricultura depende do tipo de cultivo e das condições ambientais.
Os equipamentos utilizados incluem sistemas de irrigação e sistemas de ventilação em armazéns.
Aplicações na Indústria Espacial
O oxigênio é essencial para o funcionamento de sistemas de suporte à vida em missões espaciais. Ele é utilizado para a respiração dos astronautas e para a geração de energia em sistemas de propulsão. A eficácia do oxigênio nessas aplicações é crucial para a sobrevivência e o sucesso das missões. Os equipamentos utilizados incluem sistemas de reciclagem de oxigênio e tanques de armazenamento de oxigênio.
Tabela de Aplicações do Oxigênio
| Setor | Aplicações | Equipamentos | Eficácia |
|---|---|---|---|
| Medicina | Respiração artificial, suporte à vida | Cilindros de oxigênio, máscaras faciais, respiradores | Alta, dependendo da condição do paciente |
| Metalurgia | Conversão Bessemer, fornos de arco elétrico | Injetores de oxigênio, sistemas de monitoramento | Alta, melhorando a qualidade do aço |
| Química | Produção de metanol, outras reações | Tanques de oxigênio, sistemas de controle de fluxo | Variável, dependendo da reação |
| Agricultura | Irrigação, armazenamento de grãos | Sistemas de irrigação, sistemas de ventilação | Moderada a alta, dependendo do cultivo |
| Espacial | Respiração, propulsão | Sistemas de reciclagem, tanques de armazenamento | Fundamental, para a sobrevivência em missões |
Importância do Oxigênio na Tecnologia
O oxigênio, apesar de parecer um elemento simples, é fundamental para o desenvolvimento e avanço da tecnologia moderna. A capacidade de controlar e utilizar o oxigênio em diversos processos, desde a produção de aço até a respiração artificial, impulsiona o progresso em diferentes áreas. Sua presença em reações químicas, processos industriais e sistemas de suporte à vida demonstra a sua importância para o desenvolvimento tecnológico.
Tabelas Periódicas e Número Atômico
A tabela periódica é uma ferramenta fundamental para organizar e compreender as propriedades dos elementos químicos. Ela nos permite prever comportamentos e relacionar as características dos átomos, facilitando o estudo da química. Imagine um guia de bolso para todos os elementos, mostrando suas semelhanças e diferenças!A organização da tabela periódica é baseada no número atômico dos elementos, que representa o número de prótons no núcleo de cada átomo.
Esse número é crucial, pois define a identidade do elemento. O oxigênio, por exemplo, possui um número atômico 8, o que significa que cada átomo de oxigênio tem 8 prótons. Essa organização sistemática revela padrões nas propriedades dos elementos, permitindo a previsão de comportamentos químicos.
Localização do Oxigênio na Tabela Periódica
A tabela periódica é uma estrutura organizada em linhas (períodos) e colunas (grupos). O oxigênio, com número atômico 8, está localizado no segundo período e no grupo 16 (antigo grupo 6A). Essa posição revela informações importantes sobre suas propriedades.
Comparação com Outros Elementos
O oxigênio é vizinho de elementos com propriedades semelhantes e contrastantes. Elementos no mesmo grupo da tabela periódica compartilham características químicas similares devido à configuração eletrônica. Por exemplo, o enxofre (número atômico 16) e o selênio (número atômico 34) estão no mesmo grupo que o oxigênio, exibindo comportamentos químicos parecidos. Em contraponto, elementos em períodos diferentes possuem propriedades distintas, refletidas em suas estruturas atômicas.
Organização da Tabela Periódica
A tabela periódica organiza os elementos de acordo com suas propriedades físicas e químicas. Os elementos são agrupados em períodos e grupos, com base em seus números atômicos e configurações eletrônicas. Essa estrutura facilita a previsão de propriedades e o estabelecimento de relações entre os elementos. A organização sistemática facilita o estudo e a compreensão da química.
Propriedades dos Elementos Vizinhos
Os elementos vizinhos ao oxigênio, no mesmo período e grupo, possuem propriedades relacionadas. Por exemplo, o flúor (número atômico 9), localizado acima do oxigênio no mesmo grupo, é um gás altamente reativo. O nitrogênio (número atômico 7), no mesmo período, é um gás diatômico relativamente inerte. Essas diferenças refletem as variações nas propriedades atômicas e estruturais dos elementos.
Tendências Periódicas Relacionadas ao Oxigênio
A tabela periódica demonstra tendências periódicas, como a eletronegatividade, o raio atômico e a energia de ionização. O oxigênio, por exemplo, exibe alta eletronegatividade, significando que ele atrai elétrons fortemente em uma ligação química. O raio atômico do oxigênio é menor que o do enxofre, devido ao aumento do número de camadas eletrônicas. Essas tendências são fundamentais para entender o comportamento químico do oxigênio e dos elementos vizinhos.
Modelo Atômico do Oxigênio
O átomo de oxigênio, fundamental para a vida na Terra, possui uma estrutura fascinante que pode ser representada por modelos visuais. Compreender sua organização interna nos permite desvendar suas propriedades químicas e suas interações com outros elementos. Vamos mergulhar no mundo microscópico do oxigênio!
Representação 3D do Átomo de Oxigênio
O oxigênio, com número atômico 8, possui 8 prótons e 8 elétrons em seu estado fundamental. Imagine um núcleo central, pequeno e denso, composto por prótons e nêutrons. Ao redor desse núcleo, em camadas orbitais, giram os elétrons, em constante movimento. Visualizar essa estrutura tridimensional é crucial para entender suas propriedades e reações. Um modelo 3D pode representar as órbitas eletrônicas como nuvens de probabilidade, indicando as regiões onde é mais provável encontrar um elétron.
Representação Gráfica do Átomo de Oxigênio
Uma representação gráfica do átomo de oxigênio pode ser ilustrada como um círculo para o núcleo, contendo 8 prótons e 8 nêutrons. Em seguida, órbitas eletrônicas, representadas por círculos concêntricos ao redor do núcleo, descrevem as camadas eletrônicas. Cada órbita, ou camada, comporta um número específico de elétrons. O modelo deve mostrar claramente a distribuição desses 8 elétrons nas camadas, de acordo com a regra de Aufbau.
Camadas Eletrônicas e Elétrons de Valência
O átomo de oxigênio possui três camadas eletrônicas. A camada mais interna, mais próxima do núcleo, é a camada K, que comporta no máximo 2 elétrons. A segunda camada, L, comporta no máximo 8 elétrons. A camada mais externa, a camada M, é a mais importante para as ligações químicas, pois contém os elétrons de valência. O oxigênio tem 6 elétrons na camada de valência (M).
Esses elétrons são os responsáveis pelas ligações com outros átomos.
Comparação com Modelos de Outros Elementos
Comparando o modelo atômico do oxigênio com outros elementos, notamos padrões e tendências na distribuição dos elétrons. Elementos com números atômicos menores terão estruturas mais simples, enquanto elementos mais pesados terão camadas eletrônicas mais complexas. As propriedades químicas de um elemento estão intrinsecamente ligadas à sua configuração eletrônica, especialmente aos elétrons de valência.
Tabela de Prótons, Nêutrons e Elétrons
| Elemento | Número Atômico (Z) | Número de Prótons | Número de Elétrons | Número de Nêutrons (Isótopo com massa 16) |
|---|---|---|---|---|
| Oxigênio | 8 | 8 | 8 | 8 |
Esta tabela demonstra a relação entre o número atômico, que define o elemento, e o número de prótons e elétrons em um átomo neutro. O número de nêutrons pode variar, levando a diferentes isótopos do mesmo elemento.
Comportamento dos Elétrons, Numero Atomico Oxigenio
Os elétrons do átomo de oxigênio ocupam órbitas ou orbitais específicos, em camadas eletrônicas. O comportamento desses elétrons, governado pelas leis da mecânica quântica, influencia as propriedades químicas do oxigênio. Diagrama de níveis de energia demonstram a energia associada a cada camada e subcamada eletrônica, que influenciam as interações do átomo.
Interação do Oxigênio com outros compostos
O oxigênio, um elemento fundamental na vida na Terra, interage com uma ampla gama de compostos, tanto orgânicos quanto inorgânicos, em reações químicas com consequências variadas, desde a combustão até a respiração celular. Essas interações desempenham papéis cruciais em processos naturais e em aplicações industriais. A compreensão dessas reações é essencial para entender o comportamento do oxigênio no meio ambiente e suas aplicações em diferentes áreas.
Reações Químicas do Oxigênio com Outros Compostos
O oxigênio (O 2) demonstra grande reatividade com diversos compostos, formando uma ampla variedade de produtos. A natureza dessas reações é influenciada por fatores como a estrutura dos reagentes, a temperatura, a pressão e a presença de catalisadores. As reações a seguir exemplificam a versatilidade do oxigênio em interagir com compostos orgânicos e inorgânicos.
| Reação | Reagentes | Produtos | Condições (Temperatura, Pressão, Catalisador) |
|---|---|---|---|
| Combustão do Metano | CH4 + 2O2 | CO2 + 2H2O | Temperatura acima de 550°C |
| Combustão do Etanol | C2H5OH + 3O2 | 2CO2 + 3H2O | Temperatura acima de 400°C |
| Reação com Sódio (Metal Alcalino) | 2Na + O2 | Na2O2 | Temperatura alta |
| Reação com Enxofre | S + O2 | SO2 | Temperatura alta |
| Oxidação de um composto contendo enxofre (ex: H2S) | 2H2S + 3O2 | 2S + 2H2O | Temperatura e pressão ambiente |
Detalhamento das Condições das Reações
A velocidade e os produtos das reações do oxigênio com outros compostos são sensíveis às condições reacionais. A temperatura, em particular, desempenha um papel crucial. A combustão do metano, por exemplo, exige uma temperatura inicial para iniciar a reação em cadeia. A reação com metais alcalinos, como o sódio, ocorre em temperaturas elevadas, devido à alta energia de ativação necessária para romper as ligações metálicas.
A presença de catalisadores pode acelerar as reações de oxidação, como na presença de metais de transição.
A equação química balanceada demonstra a proporção estequiométrica entre os reagentes e produtos.
Comparação com Reações de Outros Elementos
Comparando as reações do oxigênio com as de outros elementos, como o nitrogênio e o cloro, observa-se diferenças significativas. O oxigênio é geralmente mais reativo do que o nitrogênio em condições ambientais. Isso se deve à maior eletronegatividade do oxigênio, o que favorece a formação de ligações covalentes polares. O cloro, por sua vez, também é altamente reativo, mas suas reações com diferentes compostos podem apresentar padrões distintos.
A eletronegatividade, o estado de oxidação e as propriedades dos elementos envolvidos são fatores que influenciam as características das reações.
Importância na Natureza
As reações do oxigênio desempenham papéis essenciais em processos naturais. A respiração celular, por exemplo, envolve a reação do oxigênio com moléculas orgânicas para liberar energia. A decomposição da matéria orgânica também depende da oxidação por parte do oxigênio. A formação de rochas e minerais também está relacionada a reações de oxidação com o oxigênio. No ciclo biogeoquímico, o oxigênio está interligado com outros elementos, como carbono, hidrogênio e nitrogênio, em ciclos complexos.
Impacto Ambiental e Aplicações
As reações do oxigênio têm um impacto ambiental significativo, tanto positivo quanto negativo. A combustão, por exemplo, libera dióxido de carbono (CO 2), um gás de efeito estufa, contribuindo para o aquecimento global. Por outro lado, o oxigênio é essencial para a respiração e para a decomposição da matéria orgânica. Na indústria, o oxigênio é utilizado na produção de aço, na soldagem e em diversos processos químicos.
A compreensão e o controle dessas reações são fundamentais para minimizar os impactos negativos e maximizar as aplicações positivas.
Concluímos nossa jornada fascinante pelo mundo do oxigênio, explorando seu número atômico, propriedades atômicas, aplicações e história. Descobrimos sua importância na respiração, na combustão e em inúmeras aplicações industriais e médicas. A profundidade das informações científicas sobre o oxigênio é impressionante, mostrando sua importância para a vida na Terra. Esperamos que você tenha apreciado a jornada!
Qual a abundância relativa dos isótopos estáveis do oxigênio?
A abundância natural dos isótopos estáveis do oxigênio é aproximadamente: 16O (99,762%), 17O (0,038%), e 18O (0,200%).
Quais são os principais métodos de extração do oxigênio?
Os principais métodos incluem a criogenia, a eletrólise da água e a separação por membranas.
Quais são as aplicações médicas do oxigênio?
O oxigênio é essencial em tratamentos de respiração assistida e em diversas outras aplicações médicas.





