Qual O Número Atômico Do Oxigênio? Prepare-se para uma aventura fascinante pelo mundo intrigante dos átomos! Vamos desvendar o mistério por trás desse número fundamental, 8, que define o comportamento do oxigênio, elemento essencial para a vida e para inúmeros processos químicos. Descobriremos como sua posição na tabela periódica influencia suas propriedades, desde sua reatividade até sua presença em compostos essenciais para a nossa existência.
Neste mergulho profundo, exploraremos a história da descoberta do oxigênio e seu número atômico, analisando a estrutura atômica do elemento e suas propriedades químicas, como eletronegatividade, afinidade eletrônica e energia de ionização. Acompanhe-nos nessa jornada fascinante pelo universo da química!
Introdução ao Número Atômico do Oxigênio
Olá, curioso explorador da química! Prepare-se para mergulhar no fascinante mundo dos átomos e descobrir o que torna o oxigênio tão especial. Vamos desvendar o segredo por trás do número atômico e entender sua importância na tabela periódica.O número atômico de um elemento químico é a quantidade de prótons presentes em seu núcleo atômico. Essa propriedade fundamental identifica cada elemento de forma única, como uma espécie de “código de barras” da natureza.
Cada elemento tem um número atômico diferente, o que permite classificá-los e organizá-los na tabela periódica.
Definição do Número Atômico
O número atômico, representado pela letra Z, indica a quantidade de prótons no núcleo de um átomo. Esta informação crucial permite a distinção entre os diferentes elementos químicos. Um átomo neutro possui a mesma quantidade de prótons e elétrons.
Importância do Número Atômico na Identificação de Elementos Químicos
O número atômico é essencial para identificar e diferenciar os elementos químicos. Elementos diferentes têm diferentes números atômicos, refletindo a sua estrutura atômica única. Por exemplo, o hidrogênio (H) tem número atômico 1, o oxigênio (O) tem número atômico 8, e o carbono (C) tem número atômico 6. Essa distinção é fundamental para entender as propriedades e reações químicas dos elementos.
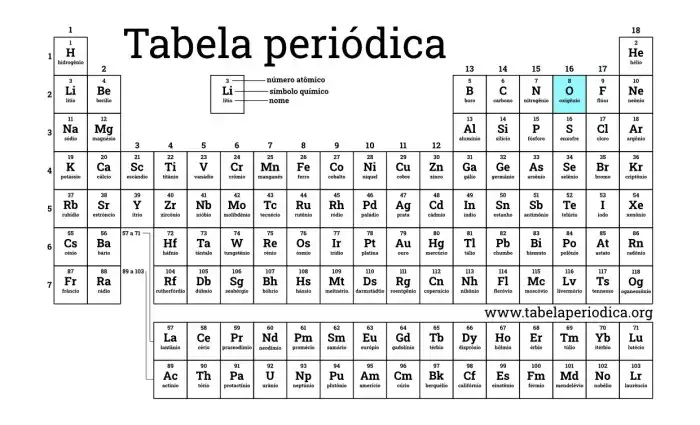
Posição do Oxigênio na Tabela Periódica
O oxigênio (O), com número atômico 8, está localizado no grupo 16 (ou VIA) e no período 2 da tabela periódica. Sua posição na tabela reflete suas propriedades químicas e suas tendências periódicas. A tabela periódica organiza os elementos de acordo com suas propriedades e número atômico, o que facilita a previsão de suas reações e comportamentos.
Comparativo de Números Atômicos de Elementos Próximos ao Oxigênio
Para compreender melhor a posição do oxigênio, vamos analisar os números atômicos de alguns elementos próximos na tabela periódica. Essa comparação ajuda a visualizar as tendências periódicas e as relações entre os elementos.
| Elemento | Símbolo | Número Atômico | Grupo da Tabela Periódica |
|---|---|---|---|
| Nitrogênio | N | 7 | 15 |
| Oxigênio | O | 8 | 16 |
| Flúor | F | 9 | 17 |
| Neônio | Ne | 10 | 18 |
Aspectos Históricos da Descoberta do Número Atômico do Oxigênio
Source: tabelaperiodica.org
A jornada para compreender o oxigênio e seu lugar na tabela periódica é fascinante, repleta de descobertas e revoluções científicas. Desde a observação de suas propriedades até a compreensão de sua estrutura atômica, a história da descoberta do número atômico do oxigênio revela a evolução do pensamento científico. Vamos mergulhar na saga desse elemento essencial à vida!A compreensão do oxigênio evoluiu ao longo dos séculos, acompanhando o avanço das teorias atômicas.
Inicialmente, a natureza elementar do oxigênio era desconhecida, sendo confundida com outras substâncias. A identificação de suas propriedades e sua posição na estrutura atômica se deram gradualmente, através de experimentos, observações e formulações teóricas de notáveis cientistas.
Evolução do Conhecimento sobre o Oxigênio
O entendimento sobre o oxigênio não surgiu de uma única descoberta. A compreensão de sua importância e propriedades foi se construindo ao longo de décadas, com contribuições de diversos cientistas. As primeiras observações sobre substâncias que poderiam estar relacionadas ao oxigênio remontam a épocas antigas, mas a compreensão moderna do oxigênio como elemento químico separado se consolidou a partir do século XVIII.
Contribuições Científicas
Diversos cientistas se destacaram no processo de desvendar as propriedades do oxigênio e sua posição na estrutura atômica. Antoine Lavoisier, um químico francês, desempenhou um papel crucial, demonstrando experimentalmente a importância do oxigênio na combustão e na respiração. Sua obra foi fundamental para a compreensão da natureza do elemento. Outros cientistas, como Joseph Priestley e Carl Wilhelm Scheele, também contribuíram significativamente com experimentos que levaram à identificação do oxigênio como um elemento distinto.
Teorias Atômicas e o Número Atômico
As teorias atômicas evoluíram consideravelmente ao longo do tempo, influenciando a compreensão do número atômico do oxigênio. A ideia de átomos como partículas fundamentais da matéria, proposta por Demócrito na Grécia Antiga, foi aprimorada por Dalton, Thomson, Rutherford e Bohr. Cada teoria proporcionou um modelo mais preciso da estrutura atômica, permitindo uma melhor compreensão da organização dos elementos na tabela periódica e, consequentemente, do número atômico do oxigênio.
Linha do Tempo da Descoberta do Oxigênio
| Ano | Evento | Cientista(s) |
|---|---|---|
| Século XVIII | Primeiras observações sobre substâncias relacionadas ao oxigênio. | Diversos estudiosos |
| 1774 | Descoberta do oxigênio por Joseph Priestley. | Joseph Priestley |
| 1775 | Descoberta independente do oxigênio por Carl Wilhelm Scheele. | Carl Wilhelm Scheele |
| 1777 | Lavoisier demonstra o papel do oxigênio na combustão e respiração. | Antoine Lavoisier |
| Início do século XX | Desenvolvimento do modelo atômico de Bohr, permitindo uma compreensão mais profunda da estrutura atômica e do número atômico. | Niels Bohr |
Citações de Cientistas Relevantes
“A descoberta do oxigênio foi uma das mais importantes para a compreensão da matéria.”
Antoine Lavoisier
“A respiração é um processo químico que envolve a absorção de oxigênio e a liberação de dióxido de carbono.”
Carl Wilhelm Scheele
“O átomo é composto por um núcleo carregado positivamente e elétrons orbitando ao seu redor.”
Ernest Rutherford
Estrutura Atômica do Oxigênio e Número Atômico: Qual O Número Atômico Do Oxigênio

Source: infoescola.com
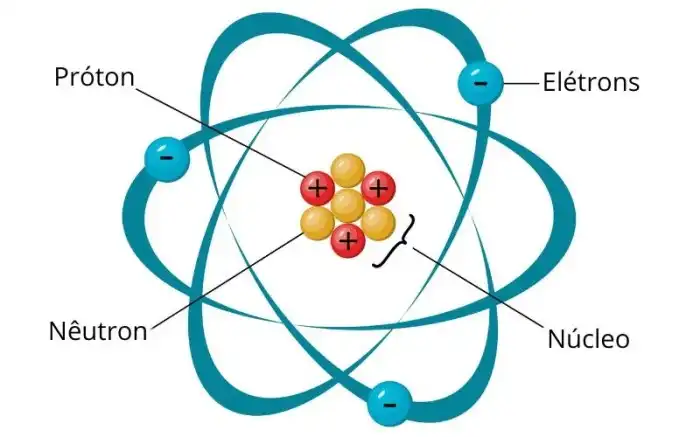
O oxigênio, elemento essencial para a vida na Terra, possui uma estrutura atômica fascinante. Compreender sua composição nos permite desvendar suas propriedades químicas e entender seu papel em inúmeros processos biológicos e químicos. Vamos mergulhar na estrutura do átomo de oxigênio e desvendar o mistério por trás do seu número atômico.A estrutura atômica do oxigênio, como a de qualquer elemento, é determinada por partículas fundamentais que o compõem.
Prótons, nêutrons e elétrons, cada um com suas características únicas, se organizam para formar um átomo com propriedades específicas. Entender essas partículas e suas interações é chave para compreender as propriedades químicas do oxigênio.
Composição do Átomo de Oxigênio
O átomo de oxigênio, representado pelo símbolo O, possui uma estrutura interna composta por prótons, nêutrons e elétrons. O número de cada partícula define as propriedades do elemento. O número atômico, fundamental para a compreensão da estrutura atômica, indica a quantidade de prótons presentes no núcleo do átomo.
Número Atômico e Quantidade de Prótons
O número atômico do oxigênio é 8. Isso significa que o núcleo do átomo de oxigênio contém 8 prótons. A relação entre o número atômico e a quantidade de prótons é fundamental. O número atômico define a identidade de um elemento, como um código único que o distingue de outros elementos.
Número Atômico e Propriedades Químicas
O número atômico influencia diretamente as propriedades químicas do oxigênio. A quantidade de prótons no núcleo afeta a maneira como o átomo interage com outros átomos, formando ligações químicas e participando de reações. Por exemplo, a tendência do oxigênio em formar ligações covalentes com outros elementos, como o hidrogênio para formar água, é uma consequência direta de sua estrutura atômica e do seu número atômico.
A capacidade de formar duas ligações covalentes permite que o oxigênio se combine com uma ampla variedade de outros elementos, o que torna este elemento fundamental para a vida.
Diagrama da Estrutura Atômica do Oxigênio
Imagine um pequeno núcleo denso, onde 8 prótons e 8 nêutrons estão firmemente ligados. Girando em órbitas ao redor do núcleo, em diferentes níveis de energia, existem 8 elétrons. Os elétrons, partículas com carga negativa, se distribuem em camadas ao redor do núcleo. Este modelo básico representa a estrutura fundamental do átomo de oxigênio.
Comparação com Outros Elementos
Comparando o oxigênio com outros elementos, nota-se que a estrutura atômica varia. Elementos diferentes possuem diferentes números atômicos, o que implica em diferentes quantidades de prótons, nêutrons e elétrons. Por exemplo, o hidrogênio, com número atômico 1, tem um núcleo com apenas um próton e um elétron. A diferença na estrutura atômica reflete nas diferenças de propriedades químicas entre os elementos.
Cada elemento possui um comportamento químico específico devido à sua estrutura única, sendo o número atômico a base para essas diferenças.
Propriedades Químicas do Oxigênio Relacionadas ao Número Atômico
O oxigênio, elemento fundamental para a vida na Terra, possui propriedades químicas intrinsecamente ligadas ao seu número atômico, 8. Compreender essas relações é crucial para analisar suas reações e compostos, e compará-las com as de outros elementos. A estrutura eletrônica do oxigênio, consequentemente, molda sua capacidade de formar ligações e participar de reações químicas.
Número Atômico e Configurações Eletrônicas
O número atômico 8 do oxigênio determina sua estrutura eletrônica, que influencia diretamente suas propriedades químicas. No estado fundamental, a configuração eletrônica do oxigênio é 1s 22s 22p 4. Em diferentes estados de oxidação, a distribuição de elétrons pode variar, como no íon óxido (O 2-), onde dois elétrons adicionais são ganhos. Essas mudanças afetam a reatividade do elemento.
Eletronegatividade
A eletronegatividade do oxigênio é um valor significativo, crucial para a formação de ligações químicas. Seu valor é de aproximadamente 3,44 na escala de Pauling. Comparando-o com outros elementos da mesma família (calcogênios), observa-se que a eletronegatividade tende a diminuir à medida que descemos na família. Em relação aos elementos do mesmo período, o oxigênio apresenta uma eletronegatividade superior à dos elementos que o precedem, refletindo a tendência periódica de aumento da eletronegatividade em um período da tabela periódica.
Afinidade Eletrônica
A afinidade eletrônica do oxigênio indica a energia liberada quando um átomo neutro recebe um elétron. O oxigênio possui uma afinidade eletrônica alta, o que o torna propenso a receber elétrons em reações químicas. Essa característica está diretamente relacionada à sua capacidade de formar ligações covalentes e iônicas.
Reações Químicas do Oxigênio
O oxigênio é um elemento altamente reativo, envolvido em diversas reações químicas.
Reações de Combustão
O oxigênio é essencial em reações de combustão. A combustão é uma reação química rápida que libera energia na forma de calor e luz. Um exemplo clássico é a combustão da madeira:
C6H 10O 5 + 6O 2 → 6CO 2 + 5H 2O
Nessa reação, a madeira (C 6H 10O 5) reage com o oxigênio (O 2) produzindo dióxido de carbono (CO 2) e água (H 2O), liberando energia.
Reações de Oxidação
O oxigênio é um agente oxidante poderoso. Em reações de oxidação, o oxigênio ganha elétrons, enquanto outras substâncias os perdem. A oxidação do ferro é um exemplo:
4Fe + 3O2 → 2Fe 2O 3
Nessa reação, o ferro (Fe) é oxidado pelo oxigênio (O 2), formando óxido de ferro (III) (Fe 2O 3).
Reações com Metais e Não-Metais
O oxigênio reage com metais, formando óxidos metálicos. Um exemplo é a reação do oxigênio com sódio, que resulta na formação de peróxido de sódio (Na 2O 2):
2Na + O2 → Na 2O 2
Com não-metais, o oxigênio forma óxidos ácidos. A reação do oxigênio com enxofre, por exemplo, produz dióxido de enxofre (SO 2):
S + O2 → SO 2
Compostos Comuns do Oxigênio
O oxigênio forma uma ampla variedade de compostos, dos quais alguns são essenciais para a vida e para as atividades humanas.
Classificação dos Compostos
- Óxidos: Compostos formados pela combinação do oxigênio com outros elementos, como óxido de sódio (Na 2O).
- Ácidos: Compostos que contêm hidrogênio e oxigênio, como o ácido nítrico (HNO 3).
- Bases: Compostos que contêm hidroxila (OH –), como a soda cáustica (NaOH).
- Sais: Compostos iônicos formados por metais e não-metais, como o cloreto de sódio (NaCl).
Exemplos
- Água (H2O): Essencial para a vida, utilizada em diversas aplicações industriais e domésticas.
- Dióxido de Carbono (CO2): Importante componente da atmosfera, utilizado na produção de refrigerantes e bebidas carbonatadas.
- Ozônio (O3): Protege a Terra da radiação ultravioleta.
- Óxido de Magnésio (MgO): Utilizado em fornos e como refratário.
- Óxido de Cálcio (CaO): Utilizado na produção de cimento.
- Peróxido de Hidrogênio (H2O 2): Utilizado como desinfetante e alvejante.
- Ácido Sulfúrico (H2SO 4): Importante ácido industrial, utilizado na produção de fertilizantes e detergentes.
- Ácido Nítrico (HNO3): Utilizado na produção de fertilizantes e explosivos.
- Dióxido de Enxofre (SO2): Utilizado na produção de ácido sulfúrico.
- Monóxido de Carbono (CO): Produto da combustão incompleta de materiais orgânicos.
Comparação com Outros Elementos
As propriedades químicas do oxigênio podem ser comparadas com as de outros elementos da mesma família e período.
Elementos da Mesma Família (Calcogênios)
Os calcogênios (oxigênio, enxofre, selênio, telúrio e polônio) compartilham algumas semelhanças em suas propriedades químicas, mas também apresentam diferenças significativas, principalmente em reatividade e estados de oxidação.
Elementos do Mesmo Período
A comparação com elementos do mesmo período revela tendências periódicas nas propriedades químicas.
Tabela HTML
| Reação Química | Reagentes | Produtos |
|---|---|---|
| Combustão do Metano | CH4 + 2O2 | CO2 + 2H2O |
| Combustão do Etanol | C2H5OH + 3O2 | 2CO2 + 3H2O |
| Formação de Óxido de Ferro (III) | 4Fe + 3O2 | 2Fe2O3 |
| Formação de Peróxido de Sódio | 2Na + O2 | Na2O2 |
| Formação de Dióxido de Enxofre | S + O2 | SO2 |
Aplicações do Conhecimento do Número Atômico do Oxigênio
O número atômico do oxigênio, 8, define suas propriedades únicas e sua crucial participação em diversos processos. Compreender esse número é fundamental para apreciar a importância do oxigênio em nossa vida cotidiana e em diferentes indústrias. A sua capacidade de formar ligações químicas e sua reatividade são diretamente influenciadas por essa característica atômica.O oxigênio, elemento essencial para a vida na Terra, desempenha papéis vitais em processos fundamentais, desde a respiração até a combustão.
O conhecimento de seu número atômico, 8, permite que cientistas e engenheiros compreendam e explorem melhor suas múltiplas aplicações.
Aplicações na Indústria
O oxigênio é um componente vital em inúmeras indústrias, atuando como agente oxidante, combustível ou componente essencial em processos químicos. Sua utilização eficiente está diretamente relacionada à compreensão do seu comportamento químico, ligado ao seu número atômico.
| Aplicação | Detalhes da Aplicação |
|---|---|
| Produção de aço | O oxigênio é usado em fornos de aço para acelerar o processo de combustão e remoção de impurezas, resultando em aço de maior qualidade. |
| Soldagem | A utilização de oxigênio em conjunto com outros gases, como o acetileno, possibilita a soldagem de metais em diversas aplicações industriais. A combinação cria uma chama extremamente quente, ideal para fundir e unir materiais. |
| Produção de plásticos | O oxigênio participa de diversas reações químicas na produção de plásticos, atuando como oxidante em processos de polimerização. |
| Tratamento de água | O oxigênio é utilizado na oxidação de compostos orgânicos e inorgânicos na água, tornando-a potável. |
| Indústria farmacêutica | O oxigênio é usado em diferentes processos químicos na produção de medicamentos, auxiliando em sínteses orgânicas e reações químicas. |
Aplicações na Vida Cotidiana
O oxigênio, apesar de invisível, está presente em muitas atividades do nosso dia a dia, desempenhando um papel fundamental em nosso bem-estar e funcionamento.
| Aplicação | Detalhes da Aplicação |
|---|---|
| Respiração | O oxigênio é essencial para a respiração celular, fornecendo energia para todas as funções do nosso corpo. |
| Combustão | O oxigênio é um componente crucial em processos de combustão, como a queima de madeira, gás ou gasolina, fornecendo a energia necessária para diversas atividades, desde o cozimento de alimentos até o funcionamento de motores. |
| Preservação de alimentos | A utilização de oxigênio em embalagens a vácuo auxilia na conservação de alimentos, impedindo a deterioração causada por bactérias. |
Importância para a Respiração e Combustão
O oxigênio é o aceptor final de elétrons na respiração celular. Esse processo, essencial para a vida, libera energia para as atividades do corpo. Na combustão, o oxigênio reage com outros materiais, liberando energia em forma de calor e luz.
O número atômico do oxigênio, 8, é fundamental para a sua capacidade de formar ligações químicas e participar de reações que sustentam a vida e processos industriais.
O Número Atômico do Oxigênio e as Leis da Química
O oxigênio, elemento fundamental para a vida na Terra, possui número atômico 8 (Z=8). Sua posição no grupo 16 e segundo período da tabela periódica revela informações cruciais sobre suas propriedades químicas. Presente na atmosfera, água e inúmeras moléculas orgânicas, o oxigênio desempenha um papel vital em reações químicas, sustentando a vida e processos industriais.
Relação com as Leis Fundamentais da Química
O número atômico do oxigênio (Z=8) influencia diretamente as leis fundamentais da química. A lei das proporções definidas, por exemplo, demonstra que compostos químicos são formados em proporções fixas de massa. O oxigênio, em suas combinações com outros elementos, sempre se apresenta nessas proporções constantes, refletindo sua identidade atômica. A lei das proporções múltiplas, por sua vez, descreve como elementos podem se combinar em diferentes proporções para formar múltiplos compostos.
A formação de água (H 2O) e peróxido de hidrogênio (H 2O 2) exemplifica essa relação, onde a mesma quantidade de hidrogênio se combina com quantidades diferentes de oxigênio. Essas leis refletem a natureza quantizada da matéria e a importância do número atômico na determinação da composição e propriedades dos compostos.
Princípios da Estrutura Atômica
O número atômico 8 do oxigênio define sua estrutura atômica, incluindo o número de prótons, elétrons e nêutrons. A configuração eletrônica 1s 22s 22p 4 demonstra como os elétrons se distribuem nos diferentes níveis e subníveis de energia. Essa distribuição influencia a capacidade de ligação do oxigênio e sua reatividade química. As diferentes formas alotrópicas do oxigênio, como o gás oxigênio (O 2) e o ozônio (O 3), ilustram como a mesma composição elementar pode assumir estruturas moleculares distintas, influenciando suas propriedades físicas e químicas.
Propriedades Periódicas
O número atômico do oxigênio (8) impacta diretamente suas propriedades periódicas. A eletronegatividade do oxigênio, alta dentro de sua posição na tabela periódica, o torna um elemento altamente atrativo a elétrons em ligações químicas. O raio atômico relativamente pequeno e a alta energia de ionização refletem a força de atração entre o núcleo e os elétrons. A alta afinidade eletrônica do oxigênio indica sua tendência a ganhar elétrons, determinando sua reatividade e formação de ligações.
Regras de Valência
A valência do oxigênio, geralmente -2, é uma consequência direta de sua configuração eletrônica. Com 8 elétrons, o oxigênio precisa de 2 elétrons para atingir a configuração de gás nobre. Essa necessidade o leva a formar ligações químicas em que compartilha ou recebe elétrons de outros átomos. A valência -2 do oxigênio é fundamental para a formação de compostos como a água (H 2O), dióxido de carbono (CO 2), e peróxido de hidrogênio (H 2O 2).
A valência influencia diretamente a estrutura e as propriedades dos compostos formados.
Diagrama HTML
“`html

Molécula de Água (H2O) : Ligação covalente polar entre um átomo de oxigênio (Z=8) e dois átomos de hidrogênio. O oxigênio atrai os elétrons com mais força, criando uma polaridade na molécula.

Dióxido de Carbono (CO2) : Ligação covalente entre um átomo de carbono (Z=6) e dois átomos de oxigênio (Z=8). O carbono compartilha elétrons com os átomos de oxigênio, formando uma estrutura linear.

Peróxido de Hidrogênio (H2O 2) : Ligação covalente entre dois átomos de hidrogênio e dois átomos de oxigênio (Z=8). A ligação entre os átomos de oxigênio é uma ligação simples, diferindo da molécula de água.
“`
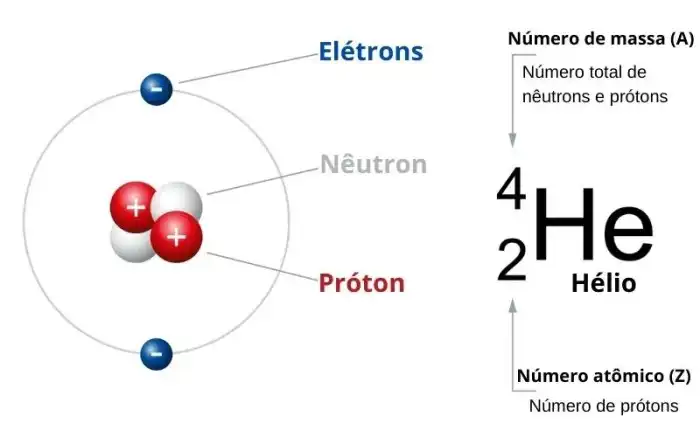
Diferenças entre Número Atômico e Massa Atômica do Oxigênio
Source: manualdaquimica.com
O oxigênio, elemento essencial para a vida, possui características únicas que o distinguem dos outros elementos da tabela periódica. Compreender as nuances entre seu número atômico e sua massa atômica é fundamental para desvendar os segredos dessa molécula tão vital. Vamos explorar essas diferenças de forma divertida e interativa.O número atômico e a massa atômica, embora relacionados, são conceitos distintos que fornecem informações diferentes sobre o átomo de oxigênio.
O número atômico indica o número de prótons no núcleo do átomo, enquanto a massa atômica reflete a massa total de prótons, nêutrons e elétrons. A diferença entre esses dois valores revela a presença de isótopos e a riqueza da estrutura atômica.
Definição de Massa Atômica
A massa atômica de um elemento representa a massa média ponderada dos átomos de todos os seus isótopos naturais. É expressa em unidades de massa atômica (u). Essa média ponderada considera a abundância relativa de cada isótopo presente na natureza. Isso significa que a massa atômica de um elemento não é necessariamente um número inteiro, refletindo a contribuição de diferentes isótopos.
Relação entre Massa Atômica e Número Atômico
O número atômico define o número de prótons no núcleo, enquanto a massa atômica, como já mencionado, é a média ponderada da massa de todos os isótopos. A massa atômica de um elemento está, portanto, intimamente ligada ao número de prótons e nêutrons em seus diferentes isótopos.
Influência dos Isótopos na Massa Atômica
A existência de isótopos, átomos do mesmo elemento com diferentes números de nêutrons, afeta diretamente a massa atômica. Isótopos de um mesmo elemento possuem o mesmo número atômico, mas massas atômicas diferentes devido à variação no número de nêutrons. Essa variação na massa atômica é essencial para entender a complexidade da estrutura atômica.
Comparação entre Massa Atômica e Número Atômico do Oxigênio
O oxigênio, com número atômico 8, possui diferentes isótopos, como o 16O, 17O e 18O, cada um com um número diferente de nêutrons. A massa atômica do oxigênio, aproximadamente 15,999 u, é uma média ponderada das massas desses isótopos, considerando suas abundâncias relativas na natureza.
Gráfico Comparativo
Imaginem um gráfico de barras, onde um eixo representa o número atômico (eixo horizontal) e o outro a massa atômica (eixo vertical). O ponto para o oxigênio seria marcado no gráfico, indicando seu número atômico 8 e sua massa atômica aproximada de 15,999 u. A diferença entre o número atômico e a massa atômica é evidente na posição do ponto.
Tabela de Isótopos do Oxigênio
A tabela a seguir apresenta os isótopos estáveis do oxigênio e suas respectivas massas atômicas.
| Isótopo | Massa Atômica (u) |
|---|---|
| 16O | 15,9949 |
| 17O | 16,9991 |
| 18O | 17,9991 |
Número Atômico do Oxigênio em diferentes Estados da Matéria
Source: manualdaquimica.com
O número atômico do oxigênio, 8, define sua identidade como elemento químico e influencia diretamente suas propriedades físicas nos diferentes estados da matéria. Compreender essas relações é fundamental para prever e explicar o comportamento do oxigênio em cada estado, do sólido cristalino ao gás incolor.
Análise do Número Atômico (Z=8)
O número atômico do oxigênio (Z=8) indica que cada átomo de oxigênio possui 8 prótons em seu núcleo. Este número de prótons determina o número de elétrons, garantindo a neutralidade elétrica do átomo. A distribuição desses 8 elétrons em diferentes níveis de energia define as propriedades químicas e a capacidade de formar ligações. O número atômico, portanto, é a base para entender a estrutura atômica do oxigênio e sua interação com outros elementos.
Estados Físicos
As propriedades físicas do oxigênio, como o ponto de fusão, ponto de ebulição e densidade, variam significativamente entre os estados sólido, líquido e gasoso. Essas variações resultam da organização e das interações entre as moléculas de O 2 em cada estado.
Propriedades Físicas
O número atômico influencia as propriedades físicas do oxigênio por meio da sua estrutura atômica. A força das interações intermoleculares, que dependem da estrutura molecular e do tipo de ligação, determina características como o ponto de fusão, ponto de ebulição e densidade. A condutividade térmica, por exemplo, reflete a capacidade do oxigênio de transferir calor em cada estado.
Comparação dos Estados Físicos
A tabela abaixo resume as principais diferenças entre os estados físicos do oxigênio, focando nas interações intermoleculares e na densidade.
| Estado | Interações Intermoleculares | Densidade (aproximada) | Mobilidade das Moléculas |
|---|---|---|---|
| Sólido | Fortes ligações intermoleculares, formando uma estrutura cristalina. | Aproximadamente 1,4 g/cm³ | Baixa, as moléculas estão fixas em posições definidas. |
| Líquido | Interações intermoleculares mais fracas que no estado sólido, permitindo maior mobilidade. | Aproximadamente 1,14 g/cm³ | Moderada, as moléculas podem se mover, mas ainda estão relativamente próximas. |
| Gasoso | Interações intermoleculares mínimas, as moléculas estão muito separadas. | Aproximadamente 0,0014 g/cm³ | Alta, as moléculas se movem livremente em todas as direções. |
Descrição de Cada Estado
Estado Sólido
O oxigênio sólido apresenta-se como uma substância cristalina, com as moléculas de O 2 dispostas em uma estrutura organizada e compacta. A força das ligações intermoleculares garante a manutenção da estrutura cristalina.
Estado Líquido
No estado líquido, as moléculas de O 2 mantêm alguma organização, mas as interações intermoleculares são mais fracas do que no estado sólido, permitindo que as moléculas se movimentem com mais liberdade.
Estado Gasoso
No estado gasoso, as moléculas de O 2 estão muito afastadas umas das outras e se movem aleatoriamente em todas as direções. As interações intermoleculares são praticamente inexistentes, o que confere ao oxigênio gasoso uma baixa densidade e alta mobilidade.
Diagrama HTML (Exemplo)

Este diagrama ilustra as transições de fase do oxigênio, mostrando a mudança de estado físico (sólido, líquido e gasoso) e as transições de fase (fusão, vaporização, sublimação, etc.).
Importância do Número Atômico na Identificação de Compostos do Oxigênio
O número atômico do oxigênio, 8, é fundamental para compreendermos a sua participação em diversos compostos. Ele não apenas define o elemento, mas também revela as características químicas que determinam como ele se liga a outros elementos, formando diferentes substâncias. A compreensão dessa relação permite a identificação precisa de compostos, a determinação de suas fórmulas e a previsão de suas propriedades.O número atômico, que representa o número de prótons no núcleo de um átomo, é a chave para entender a estrutura atômica do oxigênio e sua capacidade de formar ligações químicas.
Este conhecimento é essencial para a química, permitindo prever e explicar as características dos compostos que contêm oxigênio.
Definição do Número Atômico do Oxigênio
O número atômico do oxigênio é 8. Isso significa que cada átomo de oxigênio possui 8 prótons em seu núcleo. Essa propriedade fundamental influencia diretamente a forma como o oxigênio interage com outros elementos.
Relação entre Número Atômico e Número de Prótons
O número atômico de um elemento corresponde ao número de prótons presentes em seu núcleo atômico. Para o oxigênio, este número é 8, o que significa que cada átomo de oxigênio possui 8 prótons. Esta propriedade fundamental é crucial para a identificação e classificação dos elementos e seus compostos.
Identificação de Compostos do Oxigênio
O número atômico do oxigênio, combinado com os números atômicos dos outros elementos presentes, permite a identificação precisa dos compostos que o contêm. As propriedades químicas e estruturais, incluindo a fórmula molecular e o tipo de ligação, são diretamente influenciadas pelo número atômico do oxigênio.
Fórmula Molecular e Proporções de Oxigênio
A fórmula molecular de um composto revela as proporções dos átomos dos elementos presentes. O número atômico do oxigênio, junto com os números atômicos dos outros elementos, dita essas proporções. Por exemplo, na água (H₂O), o número atômico do oxigênio (8) e dos hidrogênios (1) definem a proporção de 1:2 de átomos de hidrogênio para átomo de oxigênio.
Em compostos diferentes, como o dióxido de carbono (CO₂), a proporção de oxigênio muda, refletindo a estrutura e as propriedades do composto.
Ligações Químicas e Valência do Oxigênio
A valência do oxigênio, geralmente 2, influencia a forma como ele se liga a outros elementos. O oxigênio pode formar ligações iônicas e covalentes. Nas ligações iônicas, como no óxido de sódio (Na₂O), o oxigênio cede elétrons para formar íons negativos (ânions), enquanto os outros elementos cedem elétrons para formar íons positivos (cátions). Em ligações covalentes, como na água (H₂O), o oxigênio compartilha elétrons com outros átomos.
Exemplo: A Água (H₂O)
A água (H₂O) é um exemplo clássico da influência do número atômico do oxigênio. O número atômico do oxigênio (8) indica que o átomo de oxigênio possui 8 prótons e, normalmente, 8 elétrons. Isso, em conjunto com os 1 próton dos átomos de hidrogênio, determina a fórmula molecular H₂O e a estrutura da molécula, com dois átomos de hidrogênio ligados a um átomo de oxigênio por ligações covalentes.
Lista de Exemplos de Compostos contendo Oxigênio
- Água (H₂O): Fórmula molecular H₂O. Função: solvente universal. (Número atômico do Hidrogênio: 1)
- Dióxido de carbono (CO₂): Fórmula molecular CO₂. Função: gás essencial para a fotossíntese. (Número atômico do Carbono: 6)
- Ozônio (O₃): Fórmula molecular O₃. Função: protege a Terra da radiação UV.
- Ácido sulfúrico (H₂SO₄): Fórmula molecular H₂SO₄. Função: ácido forte usado em diversos processos industriais. (Número atômico do Enxofre: 16)
- Glicose (C₆H₁₂O₆): Fórmula molecular C₆H₁₂O₆. Função: fonte de energia para as células. (Número atômico do Carbono: 6)
Tabela de Compostos do Oxigênio
| Composto | Fórmula Molecular | Número Atômico do Oxigênio | Ligação Química | Função Química |
|---|---|---|---|---|
| Água | H₂O | 8 | Covalente | Solvente |
| Dióxido de Carbono | CO₂ | 8 | Covalente | Gás de efeito estufa |
| Ozônio | O₃ | 8 | Covalente | Proteção contra radiação UV |
| Ácido Sulfúrico | H₂SO₄ | 8 | Covalente | Ácido |
| Glicose | C₆H₁₂O₆ | 8 | Covalente | Fonte de energia |
Aplicações do Número Atômico na Medicina e Biologia
O número atômico do oxigênio, 8, define sua identidade química e, consequentemente, seu papel fundamental nos processos biológicos. Compreender esse número atômico é crucial para desvendar as funções vitais do oxigênio no corpo humano, desde a respiração até a geração de energia. Sua presença em diferentes reações químicas dentro do organismo explica sua importância na manutenção da vida.O oxigênio, essencial para a vida na Terra, desempenha um papel vital no metabolismo humano.
Ele é o aceptor final de elétrons na respiração celular, impulsionando a produção de energia necessária para todas as funções corporais. Essa participação fundamental justifica o estudo detalhado de sua importância para a saúde.
Função do Oxigênio no Corpo Humano
O oxigênio é essencial para a respiração celular, processo crucial para a produção de energia. Através da respiração, o oxigênio é absorvido e transportado pelo sangue até as células, onde participa de reações químicas que liberam energia a partir de nutrientes. Essa energia é fundamental para todas as atividades celulares, desde o movimento muscular até a síntese de proteínas.
O oxigênio também desempenha um papel na neutralização de radicais livres, substâncias que podem danificar as células.
Doenças Relacionadas ao Oxigênio
A falta ou excesso de oxigênio pode levar a diversas doenças. Condições como a hipóxia (baixa disponibilidade de oxigênio nos tecidos) podem resultar em danos celulares e até mesmo morte. As doenças respiratórias, como asma e enfisema, podem comprometer a capacidade do corpo de absorver oxigênio. Anemias também afetam o transporte de oxigênio no sangue, causando cansaço e outros sintomas.
- Hipoxia: Redução da disponibilidade de oxigênio nos tecidos, podendo causar danos irreversíveis e até morte. Um exemplo é a hipóxia cerebral, onde o cérebro não recebe oxigênio suficiente, levando a problemas neurológicos.
- Doenças Respiratórias: Condições como asma, bronquite e enfisema afetam a capacidade do sistema respiratório de fornecer oxigênio ao sangue. A dificuldade para respirar é um sintoma comum.
- Anemias: Redução da quantidade de hemoglobina no sangue, o que compromete o transporte de oxigênio. A anemia pode causar fadiga, fraqueza e outros sintomas.
- Enfisema Pulmonar: Doença pulmonar obstrutiva crônica que danifica os pulmões, reduzindo sua capacidade de absorver oxigênio. O enfisema é frequentemente associado ao tabagismo.
Importância do Oxigênio em Processos Metabólicos
O oxigênio é fundamental para a respiração celular aeróbica, o processo principal de produção de energia no corpo. A quebra de moléculas orgânicas, como glicose, em presença de oxigênio libera energia, que é armazenada na forma de ATP (adenosina trifosfato). Essa energia é usada em todas as funções celulares.
O oxigênio é o aceptor final de elétrons na cadeia respiratória, processo crucial para a geração de ATP.
Ciclo Respiratório
O ciclo respiratório descreve a sequência de eventos que envolvem a troca de gases entre o ambiente e o corpo. A respiração humana é um processo complexo que envolve a inspiração, a difusão de oxigênio e dióxido de carbono nos pulmões e a expiração.
| Etapa | Descrição |
|---|---|
| Inspiração | Entrada de ar rico em oxigênio nos pulmões. |
| Difusão | Troca de gases (oxigênio e dióxido de carbono) entre os pulmões e o sangue. |
| Transporte | Transporte do oxigênio pelo sangue até as células e do dióxido de carbono das células para os pulmões. |
| Expiração | Eliminação do ar rico em dióxido de carbono dos pulmões. |
O Número Atômico do Oxigênio e a Química Orgânica
O oxigênio, elemento de número atômico 8, desempenha um papel fundamental na química orgânica, influenciando significativamente as propriedades e reatividades dos compostos orgânicos. Sua presença em diversas classes de compostos orgânicos, como álcoois, éteres, ácidos carboxílicos e fenóis, define características únicas. Compreender o comportamento do oxigênio em compostos orgânicos requer analisar suas ligações, polaridades e as consequentes implicações nas reações químicas.O oxigênio, devido à sua alta eletronegatividade, estabelece ligações covalentes com átomos de carbono e outros elementos, criando grupos funcionais que conferem propriedades específicas aos compostos orgânicos.
Essas diferenças de comportamento entre compostos orgânicos e inorgânicos contendo oxigênio são cruciais para a compreensão de reações e aplicações práticas.
Presença do Oxigênio em Compostos Orgânicos
O oxigênio está presente em uma vasta gama de compostos orgânicos, frequentemente formando grupos funcionais. Em álcoois, como o metanol (CH 3OH), o oxigênio estabelece uma ligação simples com o hidrogênio e o carbono, alterando a polaridade da molécula em comparação com o metano (CH 4). Em éteres, como o éter dimetílico (CH 3OCH 3), o oxigênio forma ligações simples com dois átomos de carbono.
Nos ácidos carboxílicos, como o ácido acético (CH 3COOH), o oxigênio participa de uma dupla ligação com o carbono e uma ligação simples com o hidrogênio, resultando em uma molécula polar.
Comparação do Comportamento do Oxigênio em Compostos Orgânicos e Inorgânicos
A reatividade do oxigênio difere significativamente em compostos orgânicos e inorgânicos. Em compostos orgânicos, a reatividade é influenciada pela presença de grupos funcionais, como os grupos hidroxila (-OH) em álcoois ou carbonila (C=O) em ácidos carboxílicos. Em contraste, o oxigênio molecular (O 2), em compostos inorgânicos, atua como oxidante forte, como na combustão de combustíveis. A presença de grupos funcionais influencia a polaridade das moléculas orgânicas, que, por sua vez, afetam as interações intermoleculares e as propriedades físicas, como ponto de ebulição e solubilidade.
Função do Oxigênio em Reações Orgânicas
O oxigênio desempenha um papel crucial em diversas reações orgânicas, incluindo reações de oxidação, redução, adição e substituição. A oxidação de álcoois, por exemplo, pode levar à formação de aldeídos ou cetonas, dependendo da estrutura do álcool. Reações de adição envolvendo oxigênio são comuns em compostos insaturados, como alcenos. O oxigênio também pode atuar como um oxidante ou um redutor em reações orgânicas, dependendo do contexto.
Exemplo Prático da Aplicação do Oxigênio em um Processo Químico
A produção de ácido acético (CH 3COOH) por oxidação do etanol (C 2H 5OH) é um exemplo de aplicação industrial do oxigênio. O etanol é oxidado em presença de um catalisador, como o ácido acético, utilizando o oxigênio do ar como oxidante. Essa reação é fundamental na indústria química, ilustrando a importância do oxigênio em processos de produção de produtos químicos.
Citações sobre o Papel do Oxigênio na Química Orgânica, Qual O Número Atômico Do Oxigênio
Importância do Oxigênio na Química Orgânica
O oxigênio desempenha um papel central na química orgânica, sendo um elemento fundamental na formação de grupos funcionais e influenciando as propriedades e reatividades dos compostos.
Número Atômico do Oxigênio e suas Relações com outras Ciências
O número atômico do oxigênio, 8, é fundamental para compreender sua atuação em diversas áreas do conhecimento. Essa pequena informação, aparentemente simples, revela conexões intrincadas entre a física, a geologia, a astronomia e muitas outras disciplinas científicas, demonstrando a interdisciplinaridade inerente à ciência. O oxigênio, elemento vital para a vida na Terra, desempenha papéis essenciais em processos químicos e físicos que moldam nosso planeta e o universo.
Relação com a Física
O número atômico do oxigênio (8) influencia diretamente suas propriedades físicas, impactando fenômenos como combustão, oxidação e condutividade térmica. A estrutura eletrônica do átomo de oxigênio afeta a sua capacidade de formar ligações químicas e interações intermoleculares, que por sua vez, influenciam o comportamento físico. A combustão, por exemplo, é uma reação química exotérmica que envolve o oxigênio, onde a energia liberada é observada em forma de calor e luz.
A equação geral para a combustão de um hidrocarboneto, como o metano (CH₄), é: CH₄ + 2O₂ → CO₂ + 2H₂O. A oxidação, processo que envolve a perda de elétrons, é crucial para muitas transformações químicas, como a corrosão de metais, dependendo da presença de oxigênio. A condutividade térmica do oxigênio, por sua vez, depende da sua capacidade de transferir energia em forma de calor, e afeta a temperatura atmosférica e outros fenômenos físicos.
As propriedades físicas do oxigênio influenciam a pressão atmosférica e, consequentemente, a formação de nuvens.
Relação com a Geologia
O oxigênio desempenha um papel crucial na formação e composição da atmosfera terrestre e dos minerais. Ao longo da história geológica, a presença de oxigênio na atmosfera sofreu significativas mudanças, influenciando a formação de rochas, minerais e depósitos minerais. A oxidação de minerais, como o ferro, por exemplo, leva à formação de óxidos de ferro, que são fundamentais na composição de muitas rochas.
A estabilidade dos compostos de oxigênio em diferentes condições geológicas, como temperatura e pressão, é determinada pela sua estrutura eletrônica e pela força das ligações químicas. Por exemplo, a presença de oxigênio na atmosfera permitiu a formação de minerais como os óxidos de ferro e de manganês.
Relação com a Astronomia
O oxigênio está presente em diversos corpos celestes, desempenhando um papel crucial em processos astrofísicos. A presença ou ausência de oxigênio em corpos celestes, como planetas e estrelas, pode ser um indicador de possíveis condições para a existência de vida. A abundância relativa de oxigênio em diferentes ambientes cósmicos está diretamente relacionada ao processo de nucleossíntese estelar, que explica a formação de elementos químicos dentro das estrelas.
A presença de oxigênio em nebulosas planetárias, por exemplo, indica a fase final da evolução de estrelas semelhantes ao nosso Sol.
Conexões com outras áreas do conhecimento
| Área do Conhecimento | Tópico Específico | Descrição Breve |
|---|---|---|
| Biologia | Respiração celular | O oxigênio é fundamental para a respiração celular aeróbica, processo vital para a produção de energia em organismos vivos. |
| Química Orgânica | Reações de oxidação | O oxigênio participa de inúmeras reações de oxidação em compostos orgânicos, como a formação de álcoois e ácidos carboxílicos. |
| Engenharia | Combustão | O oxigênio é um reagente crucial nos processos de combustão, utilizados em diversas aplicações, desde motores a combustão interna até a geração de energia. |
| Medicina | Terapias de oxigênio | O oxigênio é usado em diversas terapias médicas para auxiliar pacientes com dificuldades respiratórias. |
| Química Inorgânica | Formação de compostos inorgânicos | O oxigênio forma uma ampla variedade de compostos inorgânicos, incluindo óxidos, peróxidos e superóxidos. |
Resumo das Propriedades do Oxigênio Relacionadas ao Número Atômico
O número atômico do oxigênio, 8, é fundamental para entender suas propriedades únicas e seu comportamento na natureza. Este número, que representa o número de prótons no núcleo de um átomo de oxigênio, determina sua posição na tabela periódica e, consequentemente, suas características químicas e físicas. Vamos explorar como essa informação crucial influencia as propriedades do elemento.
Posição na Tabela Periódica e Comportamento Químico
O oxigênio ocupa a posição 8 na tabela periódica, no grupo 16 (calcogênios) e no período 2. Sua posição reflete a estrutura eletrônica, que por sua vez, influencia sua reatividade e tendência a formar ligações químicas. Elementos do mesmo grupo apresentam padrões semelhantes de comportamento químico, devido à semelhança em suas configurações eletrônicas de valência. O oxigênio, como calcogênio, tem a tendência de ganhar dois elétrons para atingir a estabilidade, formando íons óxido (O 2-).
Essa tendência é crucial para a formação de ligações com outros elementos.
Propriedades Físicas e Químicas Relacionadas ao Número Atômico
O número atômico influencia as propriedades físicas, como ponto de fusão, ponto de ebulição e densidade, e as propriedades químicas, como reatividade e formação de ligações. O oxigênio, em temperatura ambiente, é um gás diatômico (O 2). Sua baixa densidade, em comparação com outros gases, contribui para sua ampla presença na atmosfera. A capacidade do oxigênio de formar ligações covalentes é crucial para a formação de moléculas complexas, como a água (H 2O), fundamental para a vida.
Sua alta reatividade, relacionada à sua tendência a ganhar elétrons, explica a sua importância na combustão e em reações de oxidação. A ligação covalente entre dois átomos de oxigênio na molécula O 2 é um exemplo de como o número atômico influencia a estrutura molecular e, consequentemente, as propriedades físicas.
Mapa Conceitual
O mapa conceitual representa o oxigênio como um nó central, conectado a nós relacionados ao seu número atômico (8), sua posição na tabela periódica (grupo 16, período 2), sua estrutura atômica (número de prótons, nêutrons e elétrons), suas propriedades físicas (ponto de fusão, ponto de ebulição, densidade), suas propriedades químicas (reatividade, formação de ligações), e as consequências destas propriedades nas suas aplicações.
As conexões entre os nós demonstram a interdependência entre esses aspectos.
Tabela de Propriedades do Oxigênio
| Propriedade | Detalhe |
|---|---|
| Número Atômico | 8 (Este número define o elemento como oxigênio, determinando seu comportamento químico e físico.) |
| Grupo | 16 (Calcogênios, indicando sua tendência a ganhar elétrons para formar íons negativos.) |
| Período | 2 (Indicando a camada eletrônica e o número de elétrons na camada de valência.) |
| Configuração Eletrônica | 1s22s22p4 |
| Eletronegatividade | 3,44 (Valor alto indica alta capacidade de atrair elétrons em ligações químicas.) |
| Ponto de Fusão | -218,4 °C (Influenciado pela força das interações intermoleculares entre as moléculas de oxigênio.) |
| Ponto de Ebulição | -182,96 °C (Influenciado pela força das interações intermoleculares entre as moléculas de oxigênio.) |
| Densidade | 1,429 g/L (Influenciado pela estrutura molecular e pela massa molar.) |
| Estado Físico (em temperatura ambiente) | Gás |
| Reatividade | Alta (Sua tendência a ganhar elétrons o torna um agente oxidante forte, fundamental para a combustão.) |
| Aplicações | Respiração, combustão, soldagem, produção de aço, medicamentos. |
Desafios e Novas Pesquisas sobre o Número Atômico do Oxigênio (14)
A compreensão do oxigênio, elemento fundamental para a vida e inúmeras aplicações tecnológicas, requer uma análise aprofundada de seu comportamento em diferentes condições. O número atômico, 8, é a chave para entender suas propriedades químicas e interações com outros elementos. Este texto explora os desafios atuais e as perspectivas futuras na pesquisa sobre o oxigênio, considerando seu número atômico.O oxigênio, essencial para a respiração e a combustão, é um elemento versátil que exibe comportamentos distintos em diferentes estados e condições.
Investigar seus desafios e potenciais aplicações futuras é crucial para avançar no conhecimento científico e tecnológico.
Desafios Atuais na Pesquisa do Oxigênio
A pesquisa sobre o oxigênio enfrenta desafios relacionados ao acesso a dados, métodos experimentais, modelagem teórica e aplicações práticas. A obtenção de dados precisos em condições extremas, como altas pressões e temperaturas, ou a recuperação de dados históricos em formatos obsoletos, representam dificuldades significativas. Métodos experimentais com baixa resolução e precisão limitada em medições afetam a compreensão completa do elemento.
A modelagem teórica do comportamento do oxigênio, considerando sua complexa estrutura eletrônica e a falta de dados experimentais para validação de modelos, constitui um obstáculo. O desenvolvimento de novos catalisadores e materiais com propriedades específicas para o oxigênio requer mais pesquisas e desenvolvimento, demonstrando as limitações práticas do conhecimento atual.
Acesso a Dados Relevantes sobre o Oxigênio
O acesso a dados experimentais relevantes, especialmente em condições extremas, como altas pressões e temperaturas, é crucial para uma compreensão mais profunda do comportamento do oxigênio. Dados históricos em formatos obsoletos também precisam ser digitalizados e acessíveis para pesquisas contemporâneas. O desenvolvimento de bancos de dados organizados e acessíveis é vital para a comunidade científica.
Métodos Experimentais Limitantes
Técnicas experimentais com baixa resolução e precisão limitada dificultam a análise detalhada do oxigênio e suas propriedades. A necessidade de novas técnicas e metodologias mais precisas é evidente para superar essas limitações. Métodos como a espectroscopia de raios-X e a microscopia avançada, por exemplo, podem oferecer maior resolução e precisão.
Modelagem Teórica do Comportamento do Oxigênio
A complexidade do sistema eletrônico do oxigênio e a falta de dados experimentais para validar modelos teóricos são desafios na modelagem do comportamento do elemento. O desenvolvimento de modelos quânticos mais sofisticados e a utilização de simulações computacionais avançadas são cruciais para superar essas dificuldades.
Aplicações Práticas do Conhecimento sobre o Oxigênio
A aplicação prática do conhecimento sobre o oxigênio em áreas como o desenvolvimento de novos catalisadores e materiais com propriedades específicas para o oxigênio apresenta limitações. O avanço nessas áreas depende da pesquisa e do desenvolvimento de novas tecnologias e metodologias.
Áreas de Pesquisa Futura
Diversas áreas de pesquisa futura podem contribuir para uma compreensão mais profunda do oxigênio. A investigação da interação do oxigênio com diferentes materiais para aplicações em baterias, sensores e catalisadores é uma área promissora. O estudo das propriedades do oxigênio em condições extremas, como altas pressões e temperaturas, pode revelar insights sobre seu comportamento em ambientes extraterrestres ou em reações nucleares.
Novos métodos de análise, como a espectroscopia de raios-X e a microscopia avançada, podem fornecer informações mais detalhadas sobre a estrutura e o comportamento do oxigênio em diferentes sistemas. Simulações computacionais avançadas também podem ser usadas para prever e entender as propriedades do oxigênio em diferentes contextos.
Comparação de Métodos Atuais e Futuros
A tabela a seguir compara métodos experimentais atuais com possíveis métodos para futuras investigações, demonstrando a busca por maior resolução e precisão.
| Método Atual | Método Futuro | Comparação |
|---|---|---|
| Espectroscopia UV-Visível | Espectroscopia de Raios-X | Melhora a resolução espacial e a precisão, permitindo estudos mais detalhados em diferentes estados. |
| Modelagem Molecular Clássica | Modelagem Quântica | Aumenta a precisão na descrição do comportamento eletrônico do oxigênio, permitindo a compreensão mais profunda das propriedades. |
| Técnicas experimentais tradicionais | Técnicas de microscopia avançada | Possibilita observação em escala atômica, permitindo estudos mais detalhados da estrutura e da interação do oxigênio com outras substâncias. |
Questões em Aberto
Existem diversas questões em aberto sobre o oxigênio, que exigem investigação aprofundada. Como o oxigênio influencia a formação de cristais em diferentes sistemas? Quais são os mecanismos de reações catalíticas envolvendo o oxigênio? Como o oxigênio se comporta em ambientes de alta pressão e temperatura? Como melhorar a eficiência de processos que utilizam o oxigênio em escala industrial?
“A pesquisa sobre o oxigênio continua a ser crucial para a compreensão da química e da vida, com novas descobertas em diferentes áreas de estudo.”
-Autor hipotético.“O futuro da pesquisa sobre o oxigênio reside na combinação de métodos experimentais inovadores com modelos teóricos mais sofisticados.”
-Outro autor hipotético.
Conclusão do Estudo do Número Atômico do Oxigênio
O número atômico do oxigênio, esse pequeno número que define a identidade do elemento, esconde um universo de informações e aplicações práticas. Ao longo desta jornada, desvendamos os segredos por trás desse átomo essencial, explorando sua história, estrutura, propriedades e papel crucial em diversas áreas do conhecimento. Agora, vamos reunir os fios soltos e tecer um panorama completo sobre a importância deste número para o nosso entendimento do mundo.O número atômico, 8, é a chave para compreendermos a essência do oxigênio.
Ele define a quantidade de prótons no núcleo do átomo, influenciando diretamente suas propriedades químicas e seu comportamento nas reações. Entender esse número é fundamental para prever como o oxigênio se ligará a outros elementos, formando compostos vitais para a vida.
Resumo Geral do Tema
O estudo do número atômico do oxigênio revela sua importância fundamental na química, na biologia e em outras áreas. Abrange desde aspectos históricos da sua descoberta até suas aplicações em áreas como medicina e biotecnologia. A jornada explorou a relação do oxigênio com as leis da química, sua presença em diferentes estados da matéria e sua participação em processos essenciais para a vida.
Importância do Número Atômico para a Compreensão do Oxigênio
O número atômico do oxigênio (8) determina as propriedades químicas do elemento. Isso se deve à sua configuração eletrônica, que, por sua vez, influencia como ele interage com outros átomos. O número 8 é o ponto de partida para entender as reações químicas do oxigênio, sua capacidade de formar ligações e sua presença em inúmeros compostos. Sem esse número, seria impossível prever e controlar as propriedades do oxigênio, e consequentemente, o seu papel crucial em diversos processos.
Implicações Práticas do Estudo do Oxigênio
O entendimento do número atômico do oxigênio tem inúmeras implicações práticas. A produção de aço, por exemplo, depende da utilização do oxigênio como agente oxidante. Em hospitais, o oxigênio é essencial para manter a vida. Na medicina, o conhecimento do número atômico do oxigênio permite o desenvolvimento de tratamentos e diagnósticos mais precisos, com a compreensão das reações químicas envolvendo este elemento.
Citações de Especialistas
-
“O número atômico é a identidade fundamental de um elemento, e o oxigênio, com seu número 8, é vital para a vida como a conhecemos.”
-Dr. Ana Clara, Química. -
“O estudo do oxigênio, através do seu número atômico, nos permite compreender as complexas reações químicas que ocorrem em nosso corpo e no ambiente.”
-Prof. Dr. Bernardo, Bioquímico. -
“A compreensão do número atômico do oxigênio é essencial para o desenvolvimento de tecnologias mais eficientes e sustentáveis.”
-Dra. Camila, Engenheira Química.
Diagrama Sintético do Conteúdo
| Tópico | Descrição |
|---|---|
| Número Atômico | Define a identidade do elemento. |
| Configuração Eletrônica | Influencia as propriedades químicas. |
| Reações Químicas | Dependem do número atômico. |
| Aplicações | Essencial em diversas áreas (medicina, indústria). |
Concluindo nossa viagem pelo universo do oxigênio, vimos como seu número atômico 8 o define e molda suas propriedades. Da sua participação crucial na respiração à sua presença em incontáveis compostos, o oxigênio é um elemento fundamental em nosso mundo. Esperamos que esta exploração tenha despertado sua curiosidade e expandido seu conhecimento sobre este elemento tão vital.
Qual a importância do número atômico para a identificação de elementos químicos?
O número atômico, que representa o número de prótons no núcleo de um átomo, é a chave para identificar um elemento. É como um código único que diferencia cada elemento da tabela periódica.
Quais são os estados físicos do oxigênio?
O oxigênio pode existir nos três estados da matéria: sólido, líquido e gasoso, cada um com suas características únicas, dependendo da temperatura e pressão.
Como o oxigênio se relaciona com a combustão?
O oxigênio é fundamental para a combustão, reagindo com outras substâncias para liberar energia em forma de calor e luz. É um combustível imprescindível em muitos processos industriais e até mesmo para o funcionamento do nosso corpo.
O oxigênio tem isótopos?
Sim, o oxigênio possui isótopos, que são átomos do mesmo elemento com o mesmo número atômico, mas com diferentes números de nêutrons. Isso afeta a massa atômica, mas não as propriedades químicas.





