Número Atômico Do Oxigênio: Prepare-se para uma jornada fascinante pelo mundo dos átomos! Vamos desvendar os segredos por trás do número atômico 8, explorando sua posição na tabela periódica, sua estrutura atômica, e como essa informação fundamental impacta suas propriedades e aplicações em diversas áreas do conhecimento. Acompanhe-nos nesta aventura científica!
O oxigênio, elemento essencial para a vida na Terra, possui um número atômico que o diferencia de outros elementos. Este número, 8, é a chave para entender suas propriedades únicas e sua importância em processos biológicos e químicos.
Para a Explicação do Número Atômico do Oxigênio
O número atômico é uma propriedade fundamental que define os elementos químicos. Ele desempenha um papel crucial na organização da tabela periódica e na compreensão da estrutura atômica. Neste texto, exploraremos o número atômico do oxigênio, sua posição na tabela periódica, sua estrutura atômica e como ele se relaciona com outros elementos da família dos calcogênios.
Conceito de Número Atômico
O número atômico de um elemento indica o número de prótons presentes no núcleo de um átomo desse elemento. É um valor inteiro que diferencia cada elemento da tabela periódica. Sua importância reside na capacidade de identificar inequivocamente cada elemento químico.
Importância do Número Atômico na Identificação de Elementos
O número atômico permite distinguir um elemento de outro, pois cada elemento possui um número atômico único. Por exemplo, o número atômico do hidrogênio (1) é diferente do número atômico do oxigênio (8), permitindo identificá-los com precisão. Essa distinção é essencial para a compreensão das reações químicas e para a manipulação de substâncias em laboratório.
Posição do Oxigênio na Tabela Periódica
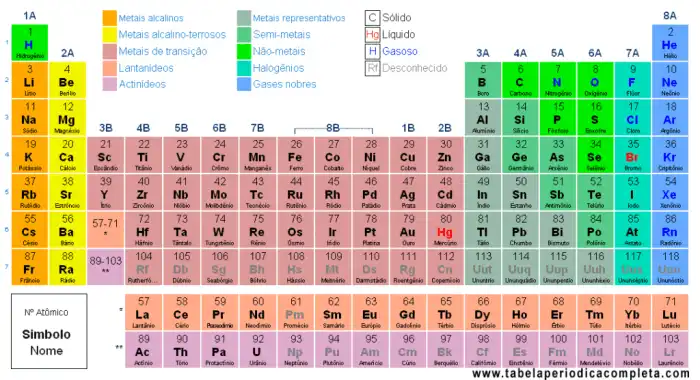
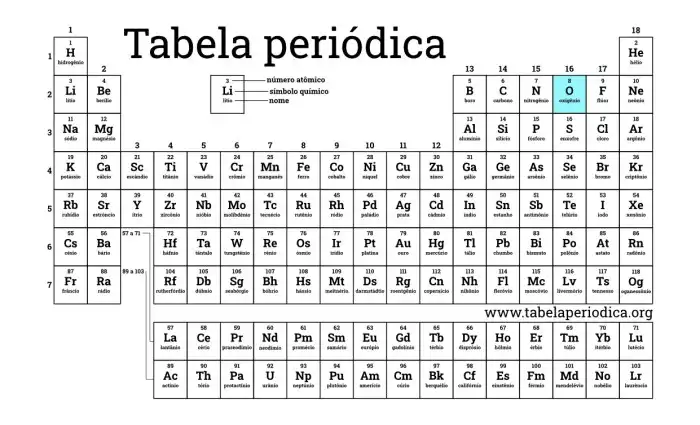
O oxigênio está localizado no grupo 16 e no período 2 da tabela periódica. Essa posição reflete as características eletrônicas do oxigênio, como sua tendência a ganhar dois elétrons para atingir a estabilidade. O número atômico 8 do oxigênio corresponde à sua posição na tabela periódica e indica o número de prótons em seu núcleo.
Estrutura Atômica do Oxigênio
O oxigênio possui 8 prótons, 8 elétrons e, em seu isótopo mais comum, 8 nêutrons no núcleo. O número atômico, 8, determina o número de elétrons em seu estado fundamental. Os elétrons orbitam o núcleo em diferentes níveis de energia, configurando a estrutura eletrônica do átomo.
Tabela Comparativa
| Elemento | Número Atômico | Símbolo | Massa Atômica (u) | Configuração Eletrônica |
|---|---|---|---|---|
| Oxigênio | 8 | O | 15,999 | 1s22s22p4 |
| Enxofre | 16 | S | 32,065 | 1s22s22p63s23p4 |
| Selênio | 34 | Se | 78,96 | 1s22s22p63s23p63d104s24p4 |
| Telúrio | 52 | Te | 127,60 | [Kr]4d105s25p4 |
| Polônio | 84 | Po | 208,98 | [Xe]4f145d106s26p4 |
Aplicações do Conhecimento
O conhecimento do número atômico do oxigênio é fundamental em diversas áreas. Na química, ele permite prever as reações do oxigênio com outros elementos. Em medicina, o oxigênio é vital para o processo respiratório, e o entendimento de sua estrutura atômica é essencial para o desenvolvimento de tratamentos médicos. Na indústria, o oxigênio é amplamente utilizado em processos de combustão e produção de aço.
Propriedades do Oxigênio Relacionadas ao Número Atômico
O número atômico do oxigênio, 8, é a chave para entender suas propriedades únicas. Ele define a estrutura do átomo de oxigênio, influenciando diretamente suas características físicas e químicas. Compreender essa relação nos permite prever e explicar como o oxigênio se comporta em diversas situações, desde sua existência no estado gasoso até sua participação em reações químicas.O número atômico, 8, indica que o oxigênio possui 8 prótons em seu núcleo.
Esta quantidade de prótons, juntamente com a configuração eletrônica resultante, define a maneira como o oxigênio interage com outros elementos, formando ligações e compostos. A influência do número atômico no comportamento do oxigênio é profunda e essencial para a compreensão de seu papel fundamental na química e na vida.
Influência do Número Atômico nas Propriedades Físicas
O número atômico, ao determinar a estrutura eletrônica do átomo de oxigênio, influencia suas propriedades físicas. A atração entre os átomos, a força das ligações intermoleculares e a disposição espacial dos átomos contribuem para a formação de um gás diatômico, O 2, na temperatura ambiente. A baixa massa molecular do oxigênio, em comparação com outros gases, resulta em um ponto de fusão e ponto de ebulição relativamente baixos.
Essas propriedades físicas estão intrinsecamente ligadas ao número atômico do oxigênio.
Influência do Número Atômico nas Propriedades Químicas
O número atômico, por sua vez, define a capacidade de oxigênio de formar ligações químicas. A eletronegatividade do oxigênio, alta para um elemento não metálico, resulta em sua tendência a formar ligações covalentes e iônicas. A reatividade do oxigênio, como agente oxidante, é diretamente influenciada por sua capacidade de ganhar elétrons. A estabilidade dos compostos formados pelo oxigênio depende das interações entre os átomos e sua estrutura eletrônica, que são consequências diretas do número atômico.
Comparação com Elementos de Números Atômicos Próximos
Comparando o oxigênio (número atômico 8) com elementos como o nitrogênio (número atômico 7) e o flúor (número atômico 9), nota-se uma variação nas propriedades químicas. O nitrogênio, com menor eletronegatividade, forma ligações mais fracas do que o oxigênio. O flúor, com maior eletronegatividade, forma compostos com uma ligação mais polar. Essas diferenças são resultado da estrutura eletrônica, que varia sutilmente entre esses elementos, refletindo a influência do número atômico.
Relação entre Número Atômico e Capacidade de Formar Compostos
A capacidade do oxigênio de formar compostos está intimamente relacionada ao seu número atômico e sua configuração eletrônica. A necessidade de completar seu octeto de elétrons, resultante do número atômico 8, leva-o a participar de diversas reações químicas. Essa característica, de completar seu octeto, é fundamental para a formação de uma vasta gama de compostos.
Exemplos de Compostos Formados pelo Oxigênio
| Composto | Número Atômico do Oxigênio | Tipo de Ligação |
|---|---|---|
| Água (H2O) | 8 | Covalente polar |
| Dióxido de carbono (CO2) | 8 | Covalente polar |
| Óxido de sódio (Na2O) | 8 | Iônica |
| Ozônio (O3) | 8 | Covalente |
A tabela acima demonstra a vasta gama de compostos que o oxigênio forma, destacando a sua versatilidade química e a relação direta com o seu número atômico. Cada composto reflete a interação do oxigênio com outros elementos, em diferentes arranjos e tipos de ligações.
Aplicações do Conhecimento do Número Atômico do Oxigênio (Número Atômico 8)
Source: z-dn.net
O oxigênio, elemento fundamental para a vida e inúmeras aplicações industriais, possui o número atômico 8. Este número atômico influencia significativamente suas propriedades e, consequentemente, suas inúmeras aplicações, desde a respiração até a produção de aço. Compreender essas aplicações é essencial para avaliar a importância estratégica deste elemento crucial em diferentes setores.O número atômico 8 do oxigênio define sua estrutura atômica, impactando sua reatividade e capacidade de formar ligações químicas.
Esta compreensão permite o desenvolvimento de tecnologias mais eficientes e a utilização do oxigênio em uma variedade de processos, desde a produção de aço até a respiração celular.
Aplicações na Indústria
O oxigênio desempenha um papel crucial em diversos setores industriais, contribuindo para processos eficientes e rentáveis. Sua alta reatividade, derivada de seu número atômico, é essencial em várias etapas da produção.
| Setor Industrial | Processo | Papel do Número Atômico | Impacto Econômico |
|---|---|---|---|
| Siderurgia | Conversão de aço | O oxigênio, com sua alta reatividade, remove eficientemente impurezas do ferro fundido, acelerando a conversão em aço. Seu número atômico 8 confere a ele a capacidade de oxidar impurezas como carbono e silício, melhorando a qualidade do aço. | Redução dos custos de produção e aumento da qualidade do aço, resultando em maior competitividade no mercado. |
| Metalurgia | Processos de soldagem e corte | O oxigênio, utilizado em conjunto com outros gases, permite o corte e a soldagem precisos de metais, influenciando diretamente na qualidade e eficiência dos processos. | Aumento da produtividade e precisão nos processos de soldagem e corte, contribuindo para a redução de custos e otimização do tempo. |
| Produção de plásticos | Processos de oxidação e polimerização | Em alguns processos de produção de plásticos, o oxigênio participa de reações de oxidação ou polimerização, influenciando diretamente na qualidade e propriedades do produto final. | Melhora das propriedades dos plásticos, como resistência e durabilidade, e maior controle sobre o processo produtivo. |
Aplicações na Vida Cotidiana
O oxigênio está presente no nosso dia a dia, sendo essencial para a vida.
- Respiração: O oxigênio é vital para a respiração humana e de outros seres vivos. Seu número atômico permite sua interação com a hemoglobina, facilitando o transporte de oxigênio pelo corpo.
- Combustão: O oxigênio é o agente oxidante fundamental em processos de combustão, desde a queima de combustíveis fósseis até a utilização em fogões e outros equipamentos.
- Produção de Água: O oxigênio é um dos componentes da água, essencial para a vida e para inúmeras aplicações.
- Tecnologia Médica: A compreensão das propriedades do oxigênio permitiu o desenvolvimento de equipamentos para suporte respiratório, como cilindros de oxigênio e respiradores artificiais.
Aplicações em Processos Biológicos
O oxigênio é fundamental para a vida, desempenhando papéis essenciais em processos biológicos cruciais.
A respiração celular é um exemplo de processo biológico onde o oxigênio é essencial. O número atômico 8 do oxigênio permite sua participação em reações químicas que geram energia para as células.

Desenvolvimento de Novas Tecnologias
O conhecimento do número atômico do oxigênio é fundamental para o desenvolvimento de novas tecnologias, como na busca por combustíveis alternativos, na criação de novos materiais e em sistemas de armazenamento de energia.
Lista de Aplicações por Setor
| Setor | Aplicação | Importância do Número Atômico |
|---|---|---|
| Medicina | Suporte respiratório | O número atômico 8 do oxigênio permite sua utilização em equipamentos de suporte respiratório. |
| Indústria | Produção de aço | A alta reatividade do oxigênio, proveniente de seu número atômico, é essencial para a remoção de impurezas no processo de produção de aço. |
| Meio Ambiente | Tratamento de poluentes | O oxigênio é utilizado em processos de tratamento de poluentes, como a oxidação de substâncias contaminantes. |
História e Evolução do Entendimento do Número Atômico do Oxigênio

Source: com.br
Embarque conosco em uma jornada fascinante pela história da descoberta do oxigênio, um elemento crucial para a vida na Terra. Vamos explorar como os modelos atômicos evoluíram, impactando nossa compreensão do número atômico do oxigênio e da sua estrutura. Prepare-se para desvendar as contribuições de cientistas notáveis que moldaram esse conhecimento.A busca pelo entendimento da matéria e de seus componentes fundamentais sempre foi um desafio intelectual.
A história da descoberta do oxigênio revela a importância da colaboração científica e da persistência na busca do conhecimento. Ao longo dos séculos, diferentes visões sobre a estrutura da matéria deram lugar a modelos mais sofisticados, impactando diretamente o nosso entendimento do número atômico do oxigênio, 8.
A Descoberta do Oxigênio: Um Laboratório de Ideias
A descoberta do oxigênio não foi obra de um único cientista, mas sim de um processo gradual de observações e experimentos. O oxigênio, essencial para a respiração e combustão, foi isolado e reconhecido como elemento por meio de experimentos de cientistas como Joseph Priestley, Carl Wilhelm Scheele e Antoine Lavoisier. Priestley, em 1774, isolou o gás, embora não tenha reconhecido sua natureza elementar imediatamente.
Scheele, simultaneamente, também isolou o gás, mas seus resultados não foram publicados tão rapidamente. Lavoisier, por meio de experimentos rigorosos, demonstrou a importância do oxigênio nas reações de combustão e respiração, consolidando sua identidade como elemento fundamental.
Evolução dos Modelos Atômicos: De Partículas a Núcleos
O entendimento da estrutura atômica evoluiu ao longo do tempo, influenciando significativamente a compreensão do número atômico do oxigênio. Inicialmente, modelos como o de Dalton, com átomos indivisíveis e indestrutíveis, foram fundamentais para a compreensão das proporções em reações químicas. Posteriormente, o modelo de Thomson, com o átomo como uma esfera de carga positiva com elétrons dispersos, abriu caminho para uma visão mais complexa.
E, mais tarde, o modelo de Rutherford, com um núcleo denso e positivo e elétrons orbitando ao redor, levou à compreensão de que o número atômico está diretamente relacionado ao número de prótons no núcleo.
A Estrutura Atômica do Oxigênio: Um Detalhe Refinado
O oxigênio, com número atômico 8, possui 8 prótons em seu núcleo. A estrutura atômica do oxigênio é composta por 8 prótons, 8 nêutrons e 8 elétrons. Os 8 elétrons orbitam o núcleo em diferentes níveis de energia, distribuídos em camadas eletrônicas, de acordo com os princípios da mecânica quântica. O entendimento da distribuição eletrônica é fundamental para prever as propriedades químicas do oxigênio, incluindo sua reatividade e formação de ligações químicas.
Contribuições de Cientistas Importantes
Diversos cientistas contribuíram para o entendimento do número atômico do oxigênio. Joseph Priestley, por suas observações e experimentos, abriu caminho para o reconhecimento do oxigênio como elemento. Antoine Lavoisier, com suas experimentos rigorosos, estabeleceu o papel crucial do oxigênio em processos como a combustão e respiração. Ernest Rutherford, com seu modelo atômico, lançou luz sobre a estrutura interna do átomo, levando ao conceito de número atômico.
Niels Bohr, com seu modelo atômico, descreveu a organização dos elétrons ao redor do núcleo, fornecendo uma base para entender as propriedades químicas dos elementos, incluindo o oxigênio.
Cronologia das Principais Descobertas Relacionadas ao Oxigênio e seu Número Atômico
- 1774: Joseph Priestley isola o oxigênio, mas não o reconhece como elemento.
- 1774: Carl Wilhelm Scheele também isola o oxigênio, mas sua publicação ocorre posteriormente.
- 1778: Antoine Lavoisier reconhece o oxigênio como elemento e descreve seu papel crucial na combustão e respiração.
- 1897: J.J. Thomson descobre o elétron, abrindo caminho para modelos atômicos mais complexos.
- 1911: Ernest Rutherford propõe um modelo atômico com um núcleo denso e positivo, levando ao conceito de número atômico.
- 1913: Niels Bohr propõe um modelo atômico com elétrons orbitando o núcleo em níveis de energia discretos.
Isótopos do Oxigênio e seu Número Atômico
Os isótopos do oxigênio são variedades do mesmo elemento químico, com propriedades ligeiramente diferentes. Apesar das variações, suas características essenciais permanecem inalteradas, como a sua posição na tabela periódica e o seu comportamento químico fundamental. Compreender os isótopos do oxigênio nos ajuda a entender a composição da matéria ao nosso redor e as propriedades únicas de cada elemento.
Conceito de Isótopos
Isótopos são átomos de um mesmo elemento químico que possuem o mesmo número de prótons, mas diferentes números de nêutrons. Isso significa que eles ocupam a mesma posição na tabela periódica e têm as mesmas propriedades químicas, mas podem apresentar diferenças nas propriedades físicas. Um exemplo simples é o carbono, que tem dois isótopos estáveis: o carbono-12 (¹²C) e o carbono-13 (¹³C).
Ambos são carbono, pois possuem 6 prótons, mas o carbono-13 possui um nêutron a mais.
Comparação e Contraste dos Isótopos do Oxigênio
Os isótopos estáveis do oxigênio, ¹⁶O, ¹⁷O e ¹⁸O, diferem no número de nêutrons em seus núcleos. Essa variação influencia suas propriedades.
Número de Prótons e Nêutrons
O oxigênio (O) tem número atômico 8, o que significa que todos os seus isótopos possuem 8 prótons. A variação no número de nêutrons é o que distingue os isótopos. O ¹⁶O tem 8 nêutrons, o ¹⁷O tem 9 nêutrons e o ¹⁸O tem 10 nêutrons. O número de massa de cada isótopo é a soma do número de prótons e nêutrons.
Massa Atômica
A massa atômica do oxigênio é calculada considerando a abundância relativa de cada isótopo. A tabela abaixo demonstra a importância dessas abundâncias. A massa atômica do oxigênio, aproximadamente 15,999 u, é uma média ponderada das massas dos seus isótopos.
Propriedades Químicas
As propriedades químicas dos isótopos do oxigênio são essencialmente idênticas. Isso ocorre porque as propriedades químicas dependem principalmente da estrutura eletrônica do átomo, que é determinada pelo número de prótons e elétrons. Como todos os isótopos de oxigênio possuem 8 elétrons, suas reações químicas serão semelhantes.
Propriedades Físicas
As propriedades físicas, como ponto de fusão e ebulição, podem apresentar pequenas diferenças entre os isótopos do oxigênio. Por exemplo, a taxa de difusão de gases pode variar devido às diferenças de massa. No entanto, essas diferenças são pequenas e normalmente não são significativas em aplicações práticas.
Constância do Número Atômico
O número atômico do oxigênio, 8, é constante para todos os seus isótopos porque todos os átomos de oxigênio possuem 8 prótons em seus núcleos. O número atômico define a identidade do elemento químico. O número de prótons no núcleo é o que determina a identidade de um elemento.
Diferenças nos Números de Massa
Os números de massa dos isótopos do oxigênio são diferentes porque o número de nêutrons varia. O número de massa é a soma do número de prótons e nêutrons no núcleo de um átomo. Essa variação não afeta a identidade do elemento químico.
Tabela de Isótopos do Oxigênio
| Isótopo | Número de Massa | Abundância Relativa (%) |
|---|---|---|
| ¹⁶O | 16 | 99,76 |
| ¹⁷O | 17 | 0,04 |
| ¹⁸O | 18 | 0,20 |
Abundâncias Relativas
As abundâncias relativas dos isótopos de oxigênio são cruciais para calcular a massa atômica do elemento. A massa atômica é uma média ponderada, onde a abundância de cada isótopo influencia seu peso na média.
Representações Visuais do Número Atômico do Oxigênio
O número atômico do oxigênio, 8, é fundamental para entender suas propriedades e comportamento. Visualizar essa informação por meio de representações gráficas facilita a compreensão e a aplicação desse conhecimento em diversas áreas, desde a química básica até a biologia molecular. Vamos explorar essas representações, desvendando os segredos por trás desse número mágico.
Estrutura Atômica do Oxigênio
A estrutura atômica do oxigênio revela a disposição dos prótons, nêutrons e elétrons em seu núcleo e camadas eletrônicas. Um átomo de oxigênio, com número atômico 8, possui 8 prótons em seu núcleo. A quantidade de elétrons é igual à quantidade de prótons, portanto, 8 elétrons orbitam o núcleo. O número atômico determina a identidade do elemento, pois define o número de prótons no núcleo.
Representação na Tabela Periódica
A tabela periódica organiza os elementos de acordo com suas propriedades. O oxigênio ocupa uma posição específica nessa tabela, revelando informações essenciais sobre seu comportamento químico. Sua posição na tabela reflete suas características e como interage com outros elementos.
Representação do Número Atômico em Diagramas Atômicos
O número atômico é um valor fundamental que define o número de prótons no núcleo de um átomo. Em diagramas de estrutura atômica, o número atômico é indicado para identificar o elemento e auxiliar na compreensão de suas características. Essa informação crucial permite a determinação do número de elétrons e, consequentemente, a previsão do comportamento químico.
Interações Eletrônicas e Número Atômico
As interações entre os elétrons do oxigênio e seu número atômico (8) influenciam diretamente as ligações químicas que o oxigênio forma. A configuração eletrônica do oxigênio (1s 22s 22p 4) e a presença de elétrons desemparelhados no orbital 2p resultam em sua tendência a formar ligações covalentes. Este aspecto influencia diretamente suas propriedades, como a capacidade de formar moléculas diatômicas (O 2).
Relação entre Número Atômico, Prótons e Elétrons
A relação entre o número atômico, o número de prótons e o número de elétrons é fundamental para a compreensão do átomo. Um átomo neutro possui o mesmo número de prótons e elétrons. No caso do oxigênio, com número atômico 8, o átomo possui 8 prótons e 8 elétrons. Essa relação é a base para a compreensão da estabilidade e do comportamento químico dos elementos.
Desafios e Aplicações Futuras
O oxigênio, elemento fundamental para a vida e com número atômico 8, desempenha papéis cruciais em inúmeras áreas, desde a respiração até processos industriais complexos. Compreender os desafios atuais e as potenciais aplicações futuras do oxigênio é essencial para otimizar seu uso e garantir sua disponibilidade para as futuras necessidades da humanidade. As tecnologias relacionadas a este elemento prometem revolucionar diversos setores, exigindo soluções inovadoras para problemas como a extração, armazenamento e transporte eficazes.
Desafios na Compreensão e Utilização do Oxigênio
A obtenção e utilização do oxigênio, considerando seu número atômico, enfrenta diversos desafios. A disponibilidade global de oxigênio, principalmente em contextos médicos e industriais, varia significativamente. Fatores geográficos, como a altitude, e econômicos, como o custo da infraestrutura, influenciam diretamente a acessibilidade a este elemento. A extração e purificação do oxigênio a partir do ar, por exemplo, exigem métodos específicos e eficientes, considerando a presença de outros gases e as condições ambientais.
- Disponibilidade e Acessibilidade: A disponibilidade de oxigênio varia de acordo com a localização geográfica. Em regiões montanhosas, a baixa concentração de oxigênio atmosférico pode demandar sistemas de suplementação. O custo da produção e transporte também afeta a acessibilidade em áreas remotas. A extração de oxigênio líquido para uso espacial requer tecnologias avançadas e recursos significativos, destacando a complexidade do processo em diferentes contextos.
- Armazenamento e Transporte: O armazenamento e transporte de oxigênio em altas concentrações requerem soluções seguras e eficazes, considerando sua natureza altamente reativa. O número atômico do oxigênio influencia diretamente a estabilidade e segurança, demandando métodos de contenção adequados. Métodos de refrigeração a baixas temperaturas são essenciais para o armazenamento de oxigênio líquido, evitando reações indesejáveis e garantindo a segurança do transporte. Sistemas de transporte seguros e eficientes para oxigênio em concentrações elevadas são fundamentais para diversas aplicações, desde hospitais até indústrias.
- Utilização em Ambientes Específicos: A utilização de oxigênio em diferentes ambientes, como ambientes médicos (terapia hiperbárica), industriais (processos de combustão) e espaciais, apresenta desafios específicos. A eficiência do oxigênio nesses contextos depende da otimização de sistemas e processos, considerando as particularidades de cada ambiente.
- Impacto Ambiental: O impacto ambiental da extração, uso e descarte do oxigênio deve ser considerado. O processo de produção de oxigênio, especialmente em larga escala, pode envolver emissões de gases de efeito estufa. A otimização das etapas de produção e utilização do oxigênio é crucial para minimizar esse impacto.
Aplicações Futuras do Oxigênio
O oxigênio, com seu número atômico 8, apresenta um potencial significativo em diversas áreas emergentes. A aplicação deste elemento em tecnologias emergentes, como baterias de oxigênio, representa um avanço na busca por fontes de energia renováveis e eficientes.
- Tecnologias Emergentes: Aplicações futuras do oxigênio em tecnologias emergentes, como baterias de oxigênio, oferecem perspectivas promissoras. As baterias de oxigênio, por exemplo, apresentam vantagens em termos de densidade energética e desempenho, em comparação com as baterias atuais. O uso de oxigênio em nanotecnologia médica também é um campo de pesquisa em rápido desenvolvimento, com potenciais aplicações inovadoras.
- Medicina Regenerativa: O oxigênio desempenha um papel crucial no metabolismo celular. Aplicações do oxigênio em terapias e tratamentos médicos, como técnicas de regeneração de tecidos e tratamento de doenças relacionadas à deficiência de oxigênio, representam avanços promissores na medicina regenerativa. A compreensão do papel do oxigênio no metabolismo celular é fundamental para o desenvolvimento de terapias mais eficazes.
- Combustíveis e Energéticos: O oxigênio como agente oxidante em combustíveis alternativos, como células de combustível a oxigênio, é um campo de pesquisa promissor. As células de combustível a oxigênio oferecem um potencial para a geração de energia de forma limpa e eficiente, minimizando a emissão de gases poluentes. O uso de oxigênio em combustíveis mais eficientes para transporte também é uma área de interesse crescente.
- Exploração Espacial: O oxigênio é essencial para a sobrevivência em missões espaciais. A produção de oxigênio in-situ em missões futuras, como na Lua ou Marte, representa um desafio tecnológico, mas com potencial de grande impacto na sustentabilidade das colônias espaciais.
Detalhes das Aplicações Futuras em Tecnologias Relacionadas
As aplicações futuras do oxigênio em tecnologias como baterias de oxigênio, combustíveis alternativos e nanotecnologia médica estão em constante desenvolvimento.
- Baterias de Oxigênio: As baterias de oxigênio utilizam o oxigênio como um dos reagentes, permitindo um maior armazenamento de energia em comparação com as baterias atuais, com um potencial para revolucionar os sistemas de armazenamento de energia.
- Combustíveis Alternativos: O oxigênio é um componente essencial em combustíveis alternativos, com o potencial de criar sistemas de combustão mais eficientes e limpos.
- Nanotecnologia Médica: O oxigênio pode ser utilizado em nanotecnologia para aplicações médicas, como a liberação controlada de oxigênio para tratamentos de tecidos danificados.
Comparação Métodos Atuais e Futuras
Os métodos atuais de produção, armazenamento e utilização do oxigênio têm limitações. Novos métodos e tecnologias futuras visam superar essas limitações, oferecendo soluções mais eficientes, seguras e sustentáveis.
Áreas de Pesquisa Relacionadas
Diversas áreas de pesquisa estão focadas em otimizar a produção, desenvolvimento de novos materiais para armazenamento e investigação de novas aplicações do oxigênio em áreas como medicina e energia. A pesquisa sobre o oxigênio continua a avançar, impulsionando a inovação em tecnologias relacionadas.
Métodos de Análise do Número Atômico do Oxigênio
Desvendar o mistério do número atômico do oxigênio, 8, exige ferramentas analíticas precisas. Diferentes técnicas, desde espectroscopia até métodos químicos, fornecem insights sobre a composição e estrutura das amostras contendo oxigênio. Compreender essas metodologias é crucial para avanços em diversas áreas, da ciência dos materiais à medicina.
Determinação do Número Atômico em Amostras
A determinação do número atômico do oxigênio em amostras envolve identificar a presença e concentração de átomos de oxigênio. Esta tarefa requer métodos capazes de identificar elementos específicos em uma matriz complexa, muitas vezes em pequenas quantidades. A precisão e sensibilidade dos métodos utilizados influenciam diretamente a confiabilidade dos resultados obtidos.
Espectroscopia Atômica
A espectroscopia atômica é uma técnica poderosa para identificar e quantificar elementos em amostras. Ela baseia-se na absorção ou emissão de luz por átomos, produzindo espectros característicos. Para o oxigênio, espectros de emissão ou absorção, como a espectroscopia de emissão atômica com plasma de argônio (ICP-OES) ou espectroscopia de absorção atômica, podem ser usados. A análise espectroscópica é capaz de fornecer informações sobre a composição elementar, incluindo a presença de oxigênio e seu número atômico.
Métodos Químicos
Métodos químicos tradicionais também são empregados para a análise do oxigênio. Reações químicas específicas permitem a determinação da concentração de oxigênio. Por exemplo, a titulação com permanganato de potássio é uma técnica clássica para quantificar oxigênio em amostras. A análise volumétrica, baseada em reações químicas, também pode ser usada para determinar a concentração de oxigênio. A escolha do método químico dependerá da natureza da amostra e do nível de precisão desejado.
Análise por Difração de Raios-X
A difração de raios-X (DRX) é uma técnica que revela a estrutura cristalina das substâncias. Através da análise das posições e intensidades dos picos de difração, é possível identificar os elementos presentes e determinar a sua estrutura cristalina. A técnica é eficaz para determinar a presença de oxigênio em compostos, mas não fornece diretamente o número atômico. Em vez disso, a DRX fornece informações sobre a estrutura do composto contendo oxigênio.
Tabela Comparativa de Métodos de Análise
| Método | Princípio | Aplicações ao Oxigênio | Limitações |
|---|---|---|---|
| Espectroscopia Atômica (ICP-OES) | Absorção ou emissão de luz por átomos | Determinação quantitativa de oxigênio em amostras diversas. | Pode ser afetada por interferências espectrais. |
| Métodos Químicos (Titulação) | Reações químicas específicas | Determinação quantitativa de oxigênio, como na análise de água. | Precisão depende da técnica e da pureza dos reagentes. |
| Difração de Raios-X (DRX) | Difração de raios-X por cristais | Identificação de compostos contendo oxigênio e estrutura cristalina. | Não determina diretamente o número atômico do oxigênio. |
Relatório Detalhado do Número Atômico do Oxigênio
Source: tabelaperiodica.org
O oxigênio, um elemento fundamental para a vida na Terra, desempenha um papel crucial em diversas reações químicas e processos biológicos. Seu número atômico, 8, define sua posição na tabela periódica e influencia suas propriedades químicas e físicas. Este relatório detalha as características do oxigênio, comparando-o com outros elementos da família dos calcogênios e explorando os métodos utilizados para determinar suas propriedades.
Dados do Oxigênio (O)
O oxigênio, representado pelo símbolo O, possui número atômico 8, o que significa que seu núcleo contém 8 prótons. Sua massa atômica é aproximadamente 15,999 u. A eletronegatividade do oxigênio é alta, refletindo sua forte tendência a atrair elétrons em ligações químicas. Seu raio atômico é relativamente pequeno, e sua configuração eletrônica é 1s 22s 22p 4.
Os estados de oxidação mais comuns do oxigênio são -2. Os pontos de fusão e ebulição são -218,4 °C e -182,96 °C, respectivamente, e sua densidade a 25 °C é de 1,429 g/L no estado gasoso.
Tabela Comparativa
A tabela a seguir compara o oxigênio com outros calcogênios, demonstrando as tendências periódicas em suas propriedades:
| Propriedade | Oxigênio (O) | Enxofre (S) | Selênio (Se) | Telúrio (Te) | Polônio (Po) |
|---|---|---|---|---|---|
| Número Atômico | 8 | 16 | 34 | 52 | 84 |
| Massa Atômica (u) | 15,999 | 32,065 | 78,96 | 127,60 | 208,98 |
| Eletronegatividade | 3,44 | 2,58 | 2,55 | 2,1 | 2,0 |
| Raio Atômico (pm) | 73 | 103 | 117 | 137 | 153 |
| Ponto de Fusão (°C) | -218,4 | 115,21 | 217 | 450 | 539 |
| Ponto de Ebulição (°C) | -182,96 | 444,6 | 685 | 990 | 962 |
Observa-se uma tendência geral de aumento no tamanho e na massa atômica, bem como no ponto de fusão e ebulição, à medida que se desce na família. A eletronegatividade, por outro lado, diminui à medida que se desce na família.
Métodos de Obtenção de Dados
As propriedades do oxigênio, assim como dos outros calcogênios, são determinadas por métodos científicos rigorosos. Espectroscopia atômica, incluindo espectroscopia de emissão e absorção atômica, são técnicas amplamente utilizadas para analisar a composição atômica e determinar os espectros de energia dos elementos. Para a determinação da massa atômica, técnicas de espectroscopia de massa fornecem dados precisos sobre a composição isotópica e a massa de cada isótopo.
Experimentos controlados em laboratório permitem a determinação dos pontos de fusão e ebulição, bem como outras propriedades físicas, sob condições específicas de pressão e temperatura.
Resumo
O oxigênio, com número atômico 8, apresenta uma massa atômica de aproximadamente 15,999 u. Sua eletronegatividade é alta (3,44), e seu raio atômico é relativamente pequeno (73 pm). Os pontos de fusão e ebulição são -218,4 °C e -182,96 °C, respectivamente. As propriedades do oxigênio seguem tendências periódicas ao longo da família dos calcogênios, mostrando variações significativas em massa, tamanho, e ponto de ebulição e fusão.
Os métodos para obtenção desses dados envolvem técnicas espectroscópicas, de determinação de massa e experimentais.
Aplicações em Química e Ciências Relacionadas
O número atômico 8 do oxigênio desempenha um papel fundamental em diversas áreas da química e ciências relacionadas, influenciando as propriedades e reações de uma vasta gama de compostos. Sua capacidade de formar ligações químicas, sua eletronegatividade e sua presença em inúmeras moléculas orgânicas e biomoléculas são aspectos cruciais para a compreensão de fenômenos químicos e biológicos.
Importância em Química Orgânica, Número Atômico Do Oxigênio
O oxigênio, com seu número atômico 8, é um elemento crucial na química orgânica, pois participa da formação de ligações covalentes e está presente em diversos grupos funcionais. Sua alta eletronegatividade confere polaridade às moléculas, o que impacta diretamente nas reações químicas. A presença do oxigênio em diferentes estruturas orgânicas influencia a geometria molecular, a reatividade e as propriedades físicas das substâncias.
- Ligações Covalentes: O oxigênio forma ligações covalentes com diversos elementos, incluindo carbono, hidrogênio e outros não metais. Essas ligações são essenciais para a estrutura e função de moléculas orgânicas.
- Grupos Funcionais: A presença do oxigênio em grupos funcionais como álcoois, éteres, ésteres, ácidos carboxílicos e aldeídos confere características específicas às moléculas orgânicas. Por exemplo, a presença de um grupo hidroxila (-OH) em um álcool confere propriedades polares e influencia na solubilidade em água.
- Comparação com Outros Elementos: Comparando o oxigênio com o enxofre e o selênio, que também pertencem à família dos calcogênios, observa-se que a eletronegatividade e a capacidade de formar ligações são gradativamente reduzidas na família. Isso reflete-se nas propriedades das moléculas que contêm esses elementos.
Comparação com Outros Elementos em Bioquímica
O oxigênio, ao lado de carbono, hidrogênio, nitrogênio e fósforo, é um elemento fundamental na composição das biomoléculas. Sua capacidade de formar ligações de hidrogênio, aliada à sua alta eletronegatividade, influencia diretamente a estrutura e a função dessas moléculas. A presença do oxigênio em carboidratos, proteínas, lipídios e ácidos nucleicos é essencial para a manutenção da vida.
- Eletronegatividade e Ligações: A alta eletronegatividade do oxigênio é crucial para a formação de ligações de hidrogênio, interações importantes na estrutura tridimensional de proteínas e ácidos nucleicos, bem como na solubilidade de biomoléculas.
- Papel em Biomoléculas: O oxigênio desempenha um papel fundamental em carboidratos, proteínas, lipídios e ácidos nucleicos, influenciando suas propriedades e funções. Por exemplo, a presença de grupos hidroxila em açúcares é crucial para a formação de polissacarídeos.
- Respiração Celular: O oxigênio é essencial para a respiração celular, onde atua como o aceptor final de elétrons na cadeia respiratória, liberando energia para as atividades celulares.
Influência em Reações Químicas e Propriedades de Compostos
O número atômico do oxigênio influencia a reatividade, o ponto de fusão, o ponto de ebulição e outras propriedades físicas e químicas de compostos. Sua participação em reações de oxidação e redução, bem como sua capacidade de formar ligações múltiplas, são fatores chave.
- Reações de Oxidação-Redução: O oxigênio atua como agente oxidante em diversas reações químicas, influindo na formação de óxidos e na liberação de energia.
- Propriedades Físicas: O ponto de ebulição e o ponto de fusão de compostos contendo oxigênio são influenciados pela força das interações intermoleculares, como ligações de hidrogênio.
Relação com a Física Atômica
A estrutura eletrônica do oxigênio, determinada pelo seu número atômico 8, impacta suas propriedades físicas, como energia de ionização e raio atômico. Princípios da física atômica, como o modelo atômico de Bohr, explicam esses comportamentos.
Importância em Combustão e Oxidação
O oxigênio é fundamental em reações de combustão, agindo como agente oxidante. A liberação de energia nessas reações é dependente da presença de oxigênio.
Aplicações em Física e Ciências Naturais
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeros processos físicos e químicos. Seu número atômico, 8, define suas propriedades únicas, impactando sua participação em reações, ligações e interações com a luz. Compreender a importância do oxigênio em processos como combustão, respiração e reações de oxirredução é fundamental para a compreensão de sistemas físicos e biológicos.
Importância do Oxigênio em Processos Físicos e Químicos
O oxigênio é essencial para diversas reações químicas e processos físicos, como a combustão, a respiração celular e as reações de oxirredução. Essas reações envolvem a transferência de elétrons e a liberação ou absorção de energia. A combustão, por exemplo, é uma reação rápida de oxidação que libera energia na forma de calor e luz. A equação química balanceada para a combustão do metano (gás natural) é: CH 4 + 2O 2 → CO 2 + 2H 2O.
Essa reação libera uma grande quantidade de energia, utilizada em diversas aplicações industriais e domésticas. A respiração celular é outro processo crucial que envolve a oxidação de moléculas orgânicas, como a glicose, para produzir energia. A equação simplificada para a respiração celular é: C 6H 12O 6 + 6O 2 → 6CO 2 + 6H 2O. Essas reações demonstram a vitalidade do oxigênio na produção de energia para organismos vivos e em processos energéticos em geral.
Número Atômico e Estrutura Atômica do Oxigênio
O número atômico 8 do oxigênio define sua posição na tabela periódica e influencia suas propriedades atômicas. O oxigênio possui 8 prótons, 8 elétrons e, em sua forma mais comum, 8 nêutrons. Essa configuração eletrônica afeta sua capacidade de formar ligações químicas. Um diagrama de estrutura atômica do oxigênio mostraria um núcleo com 8 prótons e 8 nêutrons, circundado por 8 elétrons em diferentes níveis de energia.
Essa estrutura, com dois elétrons na camada mais externa, permite a formação de ligações covalentes com outros átomos.
Ligações Químicas e Eletronegatividade do Oxigênio
A eletronegatividade do oxigênio, 3,44 na escala de Pauling, é alta, o que significa que ele atrai elétrons fortemente em uma ligação química. Isso leva à formação de ligações covalentes polares, como na molécula de água (H 2O). O diagrama de Lewis para a água mostra dois átomos de hidrogênio ligados a um átomo de oxigênio, com pares de elétrons não ligantes ao redor do oxigênio.
A polaridade da ligação O-H resulta em propriedades únicas da água, como a capacidade de dissolver diversas substâncias. A estrutura eletrônica do oxigênio, com dois elétrons na camada de valência, permite a formação de duas ligações covalentes.
Interação da Luz com o Oxigênio
O oxigênio interage com a luz em diferentes comprimentos de onda, dependendo do estado físico. O oxigênio molecular absorve luz ultravioleta, como demonstrado na camada de ozônio. Essa absorção é crucial para proteger a vida na Terra da radiação UV nociva. A interação do oxigênio com a luz visível é menos significativa, mas pode afetar a cor de materiais.
A cor de uma chama, por exemplo, pode ser influenciada pela interação da luz com as moléculas de oxigênio.
Comparação com Outros Elementos da Família
O oxigênio, enxofre e selênio são elementos da família dos calcogênios. Apesar de compartilharem semelhanças em suas propriedades químicas, como a capacidade de formar ligações covalentes, suas propriedades físicas diferem. Por exemplo, o oxigênio é um gás a temperatura ambiente, enquanto o enxofre é um sólido. As diferenças em seus pontos de fusão e ebulição, densidade e condutividade térmica podem ser atribuídas a diferenças na estrutura atômica e nas ligações intermoleculares.
A comparação entre esses elementos ilustra as tendências periódicas nas propriedades dos elementos.
Exemplos Práticos e Casos de Estudo
O número atômico do oxigênio, 8, é fundamental para compreender suas propriedades e aplicações em diversas áreas. Este número, que representa o número de prótons no núcleo do átomo de oxigênio, dita seu comportamento químico e influencia diretamente seu papel em reações e processos. Vamos explorar exemplos práticos e casos de estudo para ilustrar essa influência.
Reações Químicas e a Influência do Número Atômico
O oxigênio, com seu número atômico 8, desempenha um papel crucial em inúmeras reações químicas. Sua alta eletronegatividade o torna um agente oxidante poderoso, impulsionando a formação de óxidos e outras substâncias. A capacidade do oxigênio de se ligar a outros elementos está diretamente relacionada à sua configuração eletrônica, determinada pelo seu número atômico. Observe como a quantidade de elétrons de valência influencia a formação de ligações químicas.
- Combustão: A combustão de materiais orgânicos, como madeira ou gás natural, envolve a reação com o oxigênio. O número atômico 8 do oxigênio define a sua habilidade de aceitar elétrons durante a reação, liberando energia na forma de calor e luz. Um exemplo claro é a queima de gás metano (CH 4) com oxigênio (O 2) para produzir dióxido de carbono (CO 2) e água (H 2O).
- Respiração Celular: O oxigênio é essencial para a respiração celular em organismos aeróbicos. A presença do oxigênio no processo metabólico é crucial para a liberação de energia dos alimentos, um exemplo de reação redox onde o oxigênio atua como o aceitador final de elétrons.
- Formação de Óxidos: A reação do oxigênio com outros elementos, como o ferro, forma óxidos. A cor e a estrutura dos óxidos variam de acordo com o metal e a quantidade de oxigênio envolvida. O número atômico 8 do oxigênio determina a proporção em que se liga aos outros átomos.
Caso de Estudo: A Combustão do Propano
Um caso de estudo interessante é a combustão do propano (C 3H 8). O número atômico 8 do oxigênio influencia a proporção estequiométrica da reação. A combustão completa do propano requer uma quantidade específica de oxigênio para a formação de dióxido de carbono e água, com a liberação de energia. A falta ou excesso de oxigênio pode levar a reações incompletas, com a formação de monóxido de carbono, um gás tóxico.
A reação completa de combustão do propano é: C3H 8 + 5O 2 → 3CO 2 + 4H 2O
Aplicações da Química do Oxigênio na Vida Real
O oxigênio desempenha um papel vital em inúmeros processos da vida cotidiana. Sua presença e reatividade são fundamentais para diversos produtos e aplicações.
- Produção de aço: O oxigênio é utilizado nos altos-fornos para remover impurezas do minério de ferro, processo essencial para a produção de aço.
- Tratamento de água: O oxigênio é empregado no tratamento de água potável para eliminar impurezas e promover a oxidação de substâncias nocivas.
- Combustíveis: A presença do oxigênio é fundamental em motores de combustão interna, onde a sua reação com o combustível gera a energia necessária para o funcionamento do motor.
Influência do Número Atômico nos Experimentos
O número atômico 8 do oxigênio afeta os resultados de experimentos relacionados à sua reatividade. Experimentos que envolvem reações com oxigênio precisam considerar as proporções estequiométricas para evitar reações incompletas ou perigosas.
Tabela de Exemplos Práticos
| Categoria | Exemplo | Influência do Número Atômico |
|---|---|---|
| Reações Químicas | Combustão de madeira | O número atômico 8 do oxigênio define sua capacidade de oxidar a madeira, liberando energia. |
| Aplicações Industriais | Produção de aço | A presença de oxigênio controla a quantidade de impurezas no aço, resultando em uma liga mais resistente. |
| Processos Biológicos | Respiração celular | O oxigênio, com número atômico 8, é o aceptor final de elétrons, essencial para a liberação de energia. |
Considerações Finais Sobre o Número Atômico do Oxigênio
O número atômico do oxigênio, 8, é uma chave para entender suas propriedades e seu papel crucial em nosso universo. Essa pequena informação, aparentemente simples, abre portas para a compreensão de reações químicas, processos biológicos e até mesmo fenômenos cósmicos. Vamos mergulhar nas considerações finais sobre essa fascinante propriedade.
Importância do Número Atômico do Oxigênio
O número atômico do oxigênio, 8, define a identidade do elemento. Ele determina o número de prótons no núcleo do átomo de oxigênio, e esse número influencia diretamente as suas características químicas e físicas. Compreender esse número fundamental é essencial para predizer e explicar o comportamento do oxigênio em diversas reações e aplicações.
Relação entre Número Atômico e Propriedades do Oxigênio
O número atômico do oxigênio, 8, está intrinsecamente ligado às suas propriedades. Por exemplo, o número de prótons afeta a carga nuclear efetiva, influenciando a reatividade do oxigênio. Essa reatividade é vital para a combustão e para a formação de moléculas complexas, como a água. A estrutura eletrônica, diretamente relacionada ao número atômico, define a capacidade do oxigênio de formar ligações químicas, determinando as suas características moleculares.
Em suma, o número atômico 8 é a base para a compreensão das propriedades químicas do oxigênio.
Aplicabilidade do Número Atômico do Oxigênio em Diversos Campos
O conhecimento do número atômico do oxigênio (8) encontra aplicação em uma ampla gama de áreas. Em química, ele é fundamental para balancear equações, prever reações e entender a estrutura molecular do oxigênio. Em biologia, é crucial para compreender a respiração celular e o papel do oxigênio na vida. Em astronomia, a presença de oxigênio em outras estrelas e planetas pode indicar a presença de condições para a existência de vida.
O número atômico do oxigênio é um conceito interdisciplinar, que conecta diversos ramos do conhecimento.
Descobertas e Informações Cruciais Sobre o Número Atômico do Oxigênio
Ao longo da história, a compreensão do número atômico do oxigênio foi evoluindo. A descoberta do oxigênio como elemento químico e a determinação de seu número atômico foram marcos importantes na história da ciência. A tabela periódica, com sua organização baseada nos números atômicos, tornou o entendimento do oxigênio e de outros elementos mais acessível. A estrutura atômica, incluindo o número de prótons, nêutrons e elétrons, é essencial para entender o comportamento químico do oxigênio e seu número atômico.
Conclusões
- O número atômico do oxigênio (8) é fundamental para a compreensão das propriedades do elemento.
- O número atômico está intrinsecamente ligado às características químicas e físicas do oxigênio, incluindo sua reatividade e capacidade de formar compostos.
- A aplicação do número atômico do oxigênio (8) é abrangente, desde a química até a biologia, e tem implicações para a compreensão de processos vitais e fenômenos cósmicos.
- A história da descoberta do oxigênio e a determinação de seu número atômico são importantes marcos no desenvolvimento da ciência.
- O número atômico (8) é uma chave para entender a estrutura atômica do oxigênio e seu papel crucial em diversos processos químicos e biológicos.
Glossário de Termos Relacionados
Olá, exploradores da ciência! Preparem-se para mergulhar em um universo de termos essenciais sobre o número atômico e o elemento oxigênio! Vamos desvendar os segredos por trás de cada definição, com exemplos práticos e ilustrações para tornar a jornada ainda mais fascinante.Este glossário apresenta uma seleção de termos fundamentais para entender o número atômico do oxigênio (8), suas propriedades e aplicações.
Cada termo é definido com clareza, oferecendo insights sobre sua importância no contexto da ciência.
Definição de Número Atômico
O número atômico de um elemento químico representa a quantidade de prótons presentes no núcleo de um átomo desse elemento. É um valor fundamental para identificar e categorizar os elementos na tabela periódica. Por exemplo, o número atômico do oxigênio é 8, indicando que cada átomo de oxigênio possui 8 prótons. Este número atômico é essencial para determinar o comportamento químico do elemento e suas reações com outros elementos.
Imagine o número atômico como a “identidade” do elemento na natureza.
Definição de Próton
Os prótons são partículas subatômicas com carga elétrica positiva. Eles são encontrados no núcleo do átomo e desempenham um papel crucial na determinação do número atômico. O número de prótons define o elemento químico. Por exemplo, o átomo de hidrogênio tem 1 próton, enquanto o átomo de oxigênio tem 8. Uma imagem representando um átomo poderia mostrar o núcleo com prótons e nêutrons, e os elétrons orbitando ao redor.
Definição de Nêutron
Os nêutrons são partículas subatômicas sem carga elétrica. Eles também residem no núcleo do átomo e contribuem para a massa atômica. O número de nêutrons pode variar em um mesmo elemento, resultando em isótopos. Uma representação gráfica poderia mostrar um núcleo com prótons e nêutrons compactados.
Definição de Elétron
Os elétrons são partículas subatômicas com carga elétrica negativa. Eles orbitam o núcleo do átomo em diferentes níveis de energia. O número de elétrons em um átomo neutro é igual ao número de prótons. Uma ilustração poderia mostrar os elétrons orbitando o núcleo em camadas, com diferentes níveis de energia.
Definição de Isótopo
Isótopos são átomos de um mesmo elemento que possuem o mesmo número atômico, mas diferentes números de nêutrons. Isso resulta em diferentes massas atômicas. Por exemplo, o oxigênio-16, o oxigênio-17 e o oxigênio-18 são isótopos do oxigênio. Uma tabela comparativa dos isótopos do oxigênio poderia destacar as diferenças em suas massas atômicas e abundância na natureza.
Definição de Massa Atômica
A massa atômica é a massa média de um átomo de um elemento, considerando a abundância relativa de seus isótopos. É expressa em unidades de massa atômica (u). A massa atômica do oxigênio é aproximadamente 16 u. Uma tabela ou gráfico poderia mostrar a massa atômica de diferentes isótopos do oxigênio e suas abundâncias.
Definição de Elemento Químico
Um elemento químico é uma substância pura constituída por átomos com o mesmo número atômico. Cada elemento tem suas próprias propriedades químicas e físicas únicas. O oxigênio é um exemplo de elemento químico, crucial para a respiração e diversas reações químicas. Uma tabela periódica poderia destacar a posição do oxigênio e suas características.
Definição de Tabela Periódica
A tabela periódica é uma organização dos elementos químicos baseada em suas propriedades e números atômicos. Os elementos com propriedades semelhantes são agrupados em famílias ou grupos. A tabela periódica é uma ferramenta essencial para os químicos e cientistas. Uma imagem da tabela periódica, com destaque para a posição do oxigênio, seria ilustrativa.
Relação entre os Termos e o Número Atômico do Oxigênio
Todos os termos apresentados estão interligados e são cruciais para compreender o elemento oxigênio e seu número atômico (8). O número atômico (8) define o oxigênio, enquanto seus isótopos, prótons, elétrons e nêutrons determinam suas propriedades únicas e reações químicas. A tabela periódica organiza os elementos de acordo com suas propriedades e o número atômico, posicionando o oxigênio em uma posição específica.
Concluindo nossa exploração do número atômico do oxigênio, vimos como esse valor fundamental define as propriedades únicas deste elemento vital. Desde sua posição na tabela periódica até suas aplicações em diversas áreas, o número atômico 8 revela a intrincada relação entre estrutura e função na natureza. Esperamos que esta jornada tenha sido esclarecedora e tenha despertado sua curiosidade sobre a beleza da ciência!
Qual a importância do número atômico na identificação dos elementos?
O número atômico, que representa o número de prótons no núcleo de um átomo, é a característica que define cada elemento químico. É como uma assinatura única, permitindo diferenciar um elemento de outro, mesmo com diferentes quantidades de nêutrons (isótopos).
Quais são os isótopos estáveis do oxigênio?
Os isótopos estáveis do oxigênio são ¹⁶O, ¹⁷O e ¹⁸O. Eles diferem no número de nêutrons, mas mantêm o mesmo número atômico (8).
Como o oxigênio é usado na vida cotidiana?
O oxigênio é essencial para a respiração, combustão, e inúmeras outras reações químicas em nosso dia a dia. Ele também é usado em processos industriais, como na produção de aço e na fabricação de plásticos.
O número atômico do oxigênio influencia suas propriedades químicas?
Sim, o número atômico do oxigênio, 8, influencia diretamente suas propriedades químicas, como sua reatividade e capacidade de formar ligações com outros elementos. Sua alta eletronegatividade, por exemplo, o torna um agente oxidante forte.





