Qual É O Número Atômico Do Oxigênio? Prepare-se para mergulhar no fascinante mundo do elemento vital para a vida! Desvendaremos os segredos por trás do número atômico do oxigênio, 8, explorando suas propriedades, aplicações e o papel crucial que desempenha em diversos processos, desde a respiração até a formação de rochas.
O oxigênio, um elemento fundamental na tabela periódica, é essencial para a vida na Terra. Sua presença na atmosfera, na água e em inúmeros compostos demonstra a sua importância em todos os níveis da natureza. Vamos desvendar as particularidades que o tornam tão especial!
Introdução ao Número Atômico do Oxigênio

Source: vecteezy.com
Olá, curioso(a) explorador(a) do mundo da química! Vamos mergulhar no fascinante conceito de número atômico, com foco especial no elemento vital: o oxigênio. Descobrir como esse número nos ajuda a identificar os elementos químicos e entender a posição estratégica do oxigênio na tabela periódica é o nosso objetivo. Prepare-se para uma jornada emocionante!O número atômico de um elemento químico é o número total de prótons presentes em seu núcleo atômico.
Essa propriedade fundamental diferencia os elementos uns dos outros na tabela periódica, servindo como uma assinatura única para cada átomo. Imagine uma espécie de código de barras atômico! Um elemento com número atômico diferente de outro terá propriedades e comportamentos químicos distintos.
Definição do Número Atômico
O número atômico (Z) de um elemento é a quantidade de prótons em seu núcleo. Essa característica é crucial para a identificação dos elementos na tabela periódica. Por exemplo, o hidrogênio, o primeiro elemento da tabela, possui um próton em seu núcleo e, portanto, um número atômico igual a 1.
Importância do Número Atômico na Identificação dos Elementos
O número atômico é fundamental para identificar um elemento, pois ele define o número de prótons no núcleo. Elementos com diferentes números atômicos têm diferentes propriedades químicas e físicas, tornando o número atômico uma ferramenta essencial para classificar e organizar os elementos. Por exemplo, o carbono (Z=6) tem propriedades muito diferentes do oxigênio (Z=8).
Posição do Oxigênio na Tabela Periódica
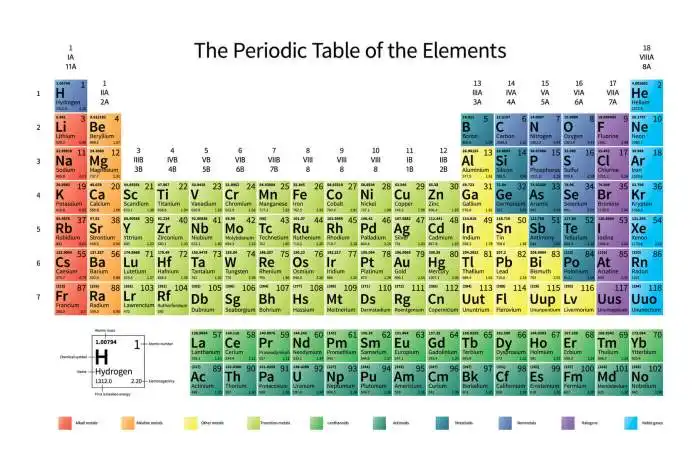
O oxigênio (O), com número atômico 8, está localizado no grupo 16 (ou 6A) e no período 2 da tabela periódica. Sua posição na tabela reflete suas propriedades químicas, como sua tendência a formar ligações covalentes e sua reatividade. O oxigênio é um elemento essencial para a vida, desempenhando um papel vital em processos como a respiração.
Tabela de Elementos Químicos e seus Números Atômicos
A tabela abaixo apresenta alguns elementos químicos e seus respectivos números atômicos, incluindo o oxigênio:
| Elemento | Símbolo | Número Atômico (Z) |
|---|---|---|
| Hidrogênio | H | 1 |
| Hélio | He | 2 |
| Carbono | C | 6 |
| Nitrogênio | N | 7 |
| Oxigênio | O | 8 |
| Fósforo | P | 15 |
| Enxofre | S | 16 |
Essa tabela ilustra a organização dos elementos com base em seus números atômicos, permitindo a comparação e o entendimento de suas propriedades. A organização da tabela periódica é uma ferramenta poderosa para prever e entender as propriedades dos elementos.
Propriedades do Oxigênio
O oxigênio, um elemento fundamental para a vida na Terra, desempenha um papel crucial em inúmeras reações químicas e processos biológicos. Sua presença é essencial para a respiração, combustão e inúmeras aplicações industriais. Neste tópico, exploraremos as características físicas e químicas do oxigênio, comparando-as com outros elementos da sua família e analisando suas diferentes formas alotrópicas e suas diversas aplicações.
Características Físicas e Químicas
O oxigênio, na sua forma mais comum, é um gás incolor, inodoro e insípido à temperatura ambiente. Apresenta-se como um gás diatômico (O 2), sendo pouco solúvel em água. Sua densidade é levemente menor que a do ar. O ponto de ebulição do oxigênio é -183°C, e o ponto de fusão é -218,8°C.
- Estado físico: Gás a temperatura ambiente.
- Ponto de fusão: -218,8°C
- Ponto de ebulição: -183°C
- Densidade: Aproximadamente 1,43 kg/m³ (a 0°C e 1 atm).
- Solubilidade em água: Baixa.
- Cor: Incolor.
- Odor: Inodoro.
O oxigênio é altamente reativo, formando ligações covalentes com a maioria dos elementos. Sua reatividade é fundamental para diversas reações de combustão, onde o oxigênio age como oxidante.
Comparação com Outros Calcogênios
O oxigênio pertence à família dos calcogênios, que inclui elementos como enxofre, selênio, telúrio e polônio. Embora apresentem algumas semelhanças, as propriedades dos calcogênios variam significativamente, especialmente em relação à reatividade e ao estado físico.
| Elemento | Ponto de Fusão (°C) | Ponto de Ebulição (°C) |
|---|---|---|
| Oxigênio (O2) | -218,8 | -183 |
| Enxofre (S) | 119 | 444,6 |
| Selênio (Se) | 217 | 685 |
| Telúrio (Te) | 450 | 1390 |
| Polônio (Po) | 254 | 962 |
A diferença nas propriedades reflete as variações nas estruturas atômicas e nos números atômicos. A eletronegatividade também influencia as características de ligação e reatividade.
Formas Alotrópicas do Oxigênio
O oxigênio apresenta diferentes formas alotrópicas, sendo as mais conhecidas o oxigênio molecular (O 2) e o ozônio (O 3). Essas formas diferem em sua estrutura molecular, o que impacta suas propriedades físicas e químicas.
- Oxigênio Molecular (O2): A forma mais comum e estável do oxigênio. É essencial para a respiração e a combustão.
- Ozônio (O3): Uma forma alotrópica menos estável, com estrutura molecular diferente do O 2. É um oxidante mais forte, com aplicações em purificação de água e tratamento de poluentes atmosféricos.
Aplicações do Oxigênio
O oxigênio tem inúmeras aplicações em diferentes setores, desde a medicina até a indústria.
- Medicina: Essencial para respiradores artificiais e suporte respiratório em pacientes com dificuldades respiratórias.
- Indústria: Utilizado em processos de soldagem, corte e tratamento térmico de metais, bem como em combustão de fornos.
- Respiração Celular: Fundamental para a respiração celular, processo vital para a obtenção de energia pelos organismos vivos.
- Combustão: O oxigênio é um componente essencial na combustão de materiais.
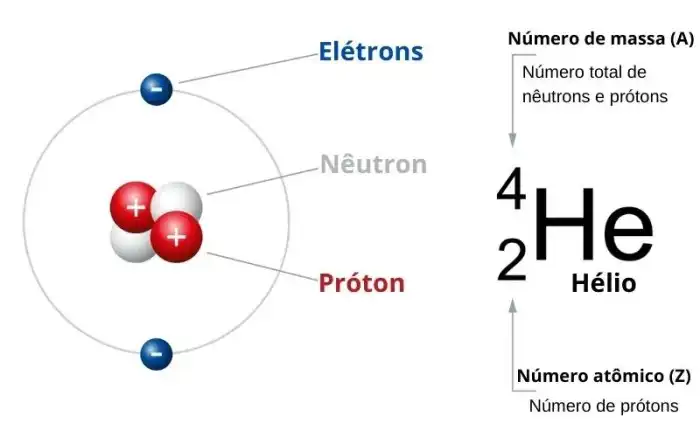
Estrutura Atômica do Oxigênio
Embarque conosco em uma jornada fascinante para desvendar os segredos da estrutura atômica do elemento vital que respiramos: o oxigênio! Imagine um minúsculo universo dentro de cada átomo de oxigênio, repleto de partículas fundamentais que governam suas propriedades e comportamento. Vamos desvendar os mistérios de seus prótons, nêutrons e elétrons, e entender a intrincada dança da configuração eletrônica.A compreensão da estrutura atômica do oxigênio é fundamental para entender suas reações químicas e seu papel crucial nos processos vitais.
A estrutura do átomo determina como ele interage com outros átomos, formando moléculas e participando de reações químicas.
Número Atômico e Composição Nuclear
O número atômico do oxigênio é 8, indicando que cada átomo de oxigênio possui 8 prótons em seu núcleo. A massa atômica, por sua vez, reflete a soma de prótons e nêutrons. A maioria dos átomos de oxigênio possui 8 nêutrons, resultando em uma massa atômica aproximada de 16 u. Entretanto, isótopos do oxigênio, com diferentes números de nêutrons, também existem na natureza.
Partículas Subatômicas do Átomo de Oxigênio
O núcleo atômico do oxigênio é composto por 8 prótons carregados positivamente e, tipicamente, 8 nêutrons, sem carga. Orbitando esse núcleo estão 8 elétrons carregados negativamente, organizados em diferentes níveis de energia. Prótons e nêutrons são muito mais massivos que os elétrons, sendo a maior parte da massa concentrada no núcleo.
Configuração Eletrônica do Oxigênio
Os elétrons em um átomo de oxigênio ocupam diferentes níveis de energia, ou camadas eletrônicas, representados por números quânticos. A configuração eletrônica do oxigênio descreve a distribuição desses elétrons nesses níveis e subníveis. O oxigênio possui dois elétrons no primeiro nível de energia (n=1) e seis elétrons no segundo nível (n=2).
- O primeiro nível de energia, mais próximo do núcleo, comporta até 2 elétrons. Este nível é chamado de camada K.
- O segundo nível de energia, mais distante do núcleo, comporta até 8 elétrons. Este nível é chamado de camada L.
A configuração eletrônica do oxigênio é 1s 22s 22p 4, o que indica a ocupação dos orbitais pelos elétrons. Esta configuração eletrônica influencia as propriedades químicas do oxigênio, como sua tendência a formar ligações químicas e sua capacidade de reagir com outros elementos.
Representação Visual da Estrutura Atômica do Oxigênio (Descrição)
Imagine um núcleo pequeno e denso no centro, representando o núcleo do átomo de oxigênio. Dentro desse núcleo, visualizamos 8 prótons e 8 nêutrons. Ao redor do núcleo, em diferentes camadas, visualizamos 8 elétrons, com dois elétrons na primeira camada (K) e seis na segunda camada (L). Os elétrons orbitam o núcleo em órbitas ou orbitais, em diferentes níveis de energia.
A disposição dos elétrons nas camadas eletrônicas e seus orbitais é fundamental para determinar as propriedades químicas do oxigênio.
Ocorrência do Oxigênio na Natureza
O oxigênio, elemento vital para a vida na Terra, está presente em uma ampla gama de formas e locais. Sua presença não se limita apenas à atmosfera, mas também é fundamental em vastas quantidades de água e inúmeros compostos químicos. Vamos mergulhar na incrível jornada do oxigênio pela natureza!O oxigênio, um elemento essencial para a vida, está presente em diversos ambientes e formas químicas.
Compreender sua ocorrência nos ajuda a apreciar sua importância para a manutenção da vida e dos processos naturais.
Principais Fontes de Oxigênio no Planeta
O oxigênio é um dos elementos mais abundantes da Terra. Ele se encontra em diversas formas, desempenhando papéis cruciais em diversos processos biológicos e geológicos. As principais fontes de oxigênio são a atmosfera, a água e uma vasta gama de compostos químicos.
- Atmosfera: O oxigênio molecular (O 2) é o componente mais abundante da atmosfera terrestre, representando cerca de 21% do ar que respiramos. Essa concentração é crucial para a respiração dos seres vivos e para a manutenção de um ambiente propício à vida.
- Água: O oxigênio está presente na água em sua forma molecular (O 2), dissolvido. Essa presença é vital para a sobrevivência de organismos aquáticos, que utilizam o oxigênio dissolvido para a respiração.
- Compostos Químicos: O oxigênio é um elemento altamente reativo, formando uma grande variedade de compostos, como óxidos, ácidos e sais. Minerais como quartzo (SiO 2) e calcário (CaCO 3) são exemplos de compostos que contêm oxigênio. A água (H 2O), o principal constituinte dos seres vivos, também contém oxigênio.
Comparação da Ocorrência do Oxigênio
A abundância e a forma de ocorrência do oxigênio variam significativamente entre a atmosfera, a água e os compostos químicos. Essa diversidade reflete a ampla gama de papéis que o oxigênio desempenha nos diferentes ambientes terrestres.
| Local | Forma | Importância |
|---|---|---|
| Atmosfera | O2 (gás) | Essencial para a respiração aeróbica. |
| Água | O2 (dissolvido) | Vital para a respiração aquática. |
| Compostos Químicos | Variada (óxidos, ácidos, sais) | Fundamental para a estrutura e função de inúmeros materiais e organismos. |
Ciclo do Oxigênio na Natureza
O ciclo do oxigênio descreve a circulação e transformações desse elemento vital no planeta. Ele é um ciclo complexo e interligado a outros ciclos biogeoquímicos, como o ciclo do carbono e o ciclo da água.
O ciclo do oxigênio é essencial para a vida na Terra.
O ciclo envolve processos de liberação, consumo e reciclagem do oxigênio em diferentes compartimentos ambientais.  O diagrama acima ilustra o ciclo do oxigênio, mostrando a interação entre os principais reservatórios de oxigênio. Ele destaca como a fotossíntese pelas plantas é a principal fonte de oxigênio na atmosfera, enquanto a respiração dos seres vivos e a decomposição de matéria orgânica consomem oxigênio.
O diagrama acima ilustra o ciclo do oxigênio, mostrando a interação entre os principais reservatórios de oxigênio. Ele destaca como a fotossíntese pelas plantas é a principal fonte de oxigênio na atmosfera, enquanto a respiração dos seres vivos e a decomposição de matéria orgânica consomem oxigênio.
Ligações Químicas do Oxigênio
Source: conceitos.com
O oxigênio, elemento essencial para a vida, demonstra uma ampla gama de ligações químicas com outros elementos, resultando em uma variedade de compostos com propriedades diversas. Compreender essas ligações é fundamental para entender a estrutura e as funções das moléculas que o oxigênio forma. Essas interações determinam as características físicas e químicas das substâncias em que ele está presente.
Ligações Químicas do Oxigênio com Outros Elementos
O oxigênio, com sua eletronegatividade elevada, forma ligações predominantemente covalentes com outros elementos. A capacidade de compartilhar elétrons com diferentes átomos permite a formação de uma ampla gama de moléculas. Abaixo, estão exemplos de ligações do oxigênio com cinco elementos representativos de diferentes grupos da tabela periódica:
- Com o Hidrogênio (H): O oxigênio forma ligações covalentes polares com o hidrogênio, resultando em moléculas de água (H 2O). A alta eletronegatividade do oxigênio atrai os elétrons compartilhados, criando uma polaridade na molécula. A estrutura de Lewis mostra dois pares de elétrons não ligantes no oxigênio e duas ligações simples com os átomos de hidrogênio. A polaridade da ligação e a geometria molecular da água são responsáveis por suas propriedades únicas, como a capacidade de formar pontes de hidrogênio.
- Com o Carbono (C): O oxigênio forma ligações covalentes polares com o carbono, resultando em diversas moléculas orgânicas, como o dióxido de carbono (CO 2). A estrutura de Lewis para o CO 2 apresenta duas ligações duplas entre o carbono e os átomos de oxigênio. A polaridade das ligações é influenciada pela diferença de eletronegatividade entre os átomos, que afeta a geometria molecular.
A molécula de CO 2, apesar de apresentar ligações polares, é apolar devido à sua geometria linear.
- Com o Sódio (Na): O oxigênio forma ligações iônicas com o sódio, resultando no óxido de sódio (Na 2O). A grande diferença de eletronegatividade entre o sódio e o oxigênio leva à transferência de elétrons do sódio para o oxigênio, formando íons Na + e O 2-. A estrutura de Lewis do Na 2O representa a atração eletrostática entre esses íons.
- Com o Flúor (F): O oxigênio forma ligações covalentes polares com o flúor, resultando em moléculas como o dióxido de diflúor (OF 2). A estrutura de Lewis mostra duas ligações simples entre o oxigênio e os átomos de flúor, com dois pares de elétrons não ligantes no oxigênio. A polaridade da ligação e a geometria molecular são importantes para determinar as propriedades físicas e químicas do composto.
- Com o Nitrogênio (N): O oxigênio forma ligações covalentes polares com o nitrogênio, como no óxido nítrico (NO). A estrutura de Lewis do NO mostra uma ligação simples e um elétron desemparelhado. A diferença de eletronegatividade entre o nitrogênio e o oxigênio gera uma polaridade na ligação, influenciando a geometria molecular e as propriedades do composto.
Comparativo dos Tipos de Ligações
A tabela abaixo demonstra as diferenças e semelhanças entre os tipos de ligações químicas formadas pelo oxigênio.
| Tipo de Ligação | Elemento com o qual o oxigênio se liga | Estruturas de Lewis | Polaridade | Ponto de Fusão/Ebulição | Forças Intermoleculares | Propriedades Físicas | Propriedades Químicas | Aplicações |
|---|---|---|---|---|---|---|---|---|
| Iônica | Sódio (Na) | Na2O | Não polar | Alto | Atração eletrostática | Sólido cristalino | Reage com água | Produção de compostos químicos |
| Covalente Polar | Hidrogênio (H), Carbono (C), Flúor (F), Nitrogênio (N) | H2O, CO2, OF2, NO | Polar | Variável | Dipolo-dipolo, pontes de hidrogênio, forças de London | Variadas (sólido, líquido, gasoso) | Reações diversas dependendo do composto | Diversas aplicações em química orgânica, indústria, etc. |
Propriedades das Moléculas Formadas
As propriedades físicas e químicas das moléculas formadas pelo oxigênio variam significativamente dependendo do elemento com o qual ele se liga. Por exemplo, a água (H 2O) é líquida em temperatura ambiente, enquanto o dióxido de carbono (CO 2) é gasoso. A solubilidade, densidade e reatividade também dependem da natureza da ligação e da geometria molecular. As propriedades químicas incluem a reatividade em diferentes meios e a estabilidade das moléculas.
Aplicações do Número Atômico do Oxigênio
O número atômico do oxigênio, 8, define sua identidade como elemento químico e impacta profundamente suas propriedades e aplicações. Compreender este número fundamental é crucial para apreciar sua importância em inúmeros contextos científicos e tecnológicos. O oxigênio, com seus oito prótons, desempenha um papel vital em reações químicas, processos biológicos e diversas tecnologias.O número atômico 8 do oxigênio, além de definir sua posição na tabela periódica, determina sua estrutura eletrônica, sua capacidade de formar ligações químicas e sua reatividade.
Essas características influenciam significativamente suas aplicações em diferentes áreas, desde a respiração celular até a produção de aço. A compreensão detalhada do comportamento do oxigênio em diversas situações é essencial para avanços tecnológicos e científicos.
Importância em Contextos Científicos
O número atômico 8 do oxigênio, determinando a presença de oito prótons em seu núcleo, influencia sua configuração eletrônica, que por sua vez afeta suas propriedades químicas, como a reatividade. A capacidade do oxigênio de formar ligações covalentes e iônicas é fundamental em inúmeras reações químicas, incluindo a formação de óxidos, essenciais em diversos processos. Sua posição na tabela periódica, especificamente como um elemento não metálico, reflete sua tendência a ganhar elétrons, o que explica sua reatividade como agente oxidante.
Este conhecimento é crucial em áreas como a química orgânica, onde o oxigênio é um elemento fundamental em muitas moléculas orgânicas, e na bioquímica, onde reações envolvendo oxigênio são centrais para a respiração celular e outras vias metabólicas. Em física, a estrutura atômica do oxigênio e suas interações são estudadas para entender a formação de moléculas e materiais.
Aplicações Práticas
O conhecimento do número atômico do oxigênio é essencial em diversas aplicações práticas. A produção de aço, por exemplo, requer o controle preciso da quantidade de oxigênio para remover impurezas e obter a qualidade desejada. Em processos industriais como a produção de plásticos e fibras sintéticas, o oxigênio desempenha um papel crucial como reagente ou como agente oxidante.
O tratamento de água também utiliza o oxigênio para remover poluentes e promover a purificação. A produção de medicamentos e a utilização de sistemas de suporte à vida em hospitais, dependendo da oxigenação, também são exemplos claros da importância do oxigênio e de suas propriedades. A compreensão de como o oxigênio se comporta em diferentes contextos permite a otimização desses processos e a criação de novas tecnologias.
Influência nas Propriedades do Oxigênio
O número atômico do oxigênio (8 prótons) influencia diretamente suas propriedades físicas e químicas. O número de prótons determina a estrutura eletrônica, que, por sua vez, afeta o ponto de fusão, ponto de ebulição, densidade e reatividade. A alta eletronegatividade do oxigênio, consequência de sua estrutura atômica, o torna um forte agente oxidante, com a capacidade de ganhar elétrons em reações químicas.
Isso explica sua importância na respiração celular e em reações de combustão. A compreensão das diferentes propriedades do oxigênio permite prever seu comportamento em diferentes ambientes e utilizar esse conhecimento em aplicações práticas. A variação na composição isotópica do oxigênio também influencia os processos biológicos e geológicos.
Lista de Exemplos de Aplicações Práticas
- Produção de aço: O oxigênio é usado para remover impurezas do minério de ferro durante a produção de aço. A quantidade precisa de oxigênio é crucial para atingir a qualidade desejada e evitar defeitos no material final. O número atômico 8 do oxigênio define suas propriedades químicas, tornando-o fundamental neste processo de refinação.
- Tratamento de água: O oxigênio é essencial no tratamento de água potável, auxiliando na oxidação de poluentes orgânicos e inorgânicos. A adição controlada de oxigênio é crucial para manter a qualidade da água e garantir sua potabilidade. O número atômico 8 do oxigênio define suas propriedades oxidantes, que são fundamentais nesse contexto.
- Produção de medicamentos: O oxigênio participa de diversas reações químicas na síntese de medicamentos. A compreensão de suas propriedades químicas é fundamental para o desenvolvimento de novas drogas e a otimização dos processos de produção. A presença do oxigênio como reagente ou produto em diversas reações químicas é diretamente relacionada ao seu número atômico.
- Sistemas de suporte à vida (medicina): A respiração celular, processo vital para a manutenção da vida, depende da disponibilidade de oxigênio. A administração adequada de oxigênio é crucial para pacientes com dificuldades respiratórias. O número atômico 8 do oxigênio é essencial para a compreensão do processo de respiração celular e para o desenvolvimento de tecnologias de suporte à vida.
- Combustão: O oxigênio é essencial para a maioria dos processos de combustão. A capacidade do oxigênio de oxidar outros elementos é a base para a liberação de energia em reações de combustão, que são amplamente utilizadas em diversos processos industriais e em nossa vida cotidiana. O número atômico 8 define as características químicas que permitem o papel do oxigênio como oxidante.
Importância do Oxigênio para a Vida

Source: vecteezy.com
O oxigênio, um elemento fundamental para a vida na Terra, desempenha um papel crucial em praticamente todos os organismos vivos. Sua presença é essencial para a respiração, um processo vital que libera energia das moléculas de alimento, impulsionando as atividades celulares e mantendo a vida. Este elemento está intrinsecamente ligado ao funcionamento de todos os seres vivos, desde as minúsculas bactérias até os gigantescos mamíferos.
Respiração em Diferentes Organismos
A forma como os organismos obtêm oxigênio e o utilizam varia significativamente. Algumas espécies, como as plantas, realizam a fotossíntese, liberando oxigênio como subproduto. Outras, como os animais, necessitam de um ambiente com oxigênio livre para obter energia. A respiração em organismos aquáticos, como peixes, requer adaptações para extrair o oxigênio dissolvido na água, enquanto organismos terrestres utilizam pulmões ou outros sistemas respiratórios para capturar o oxigênio atmosférico.
A diversidade dos métodos de obtenção e utilização do oxigênio reflete a adaptação de cada espécie ao seu ambiente.
Papel do Oxigênio no Metabolismo
O oxigênio é um reagente fundamental no processo de respiração celular. Ele atua como o aceptor final de elétrons na cadeia respiratória, um conjunto complexo de reações que extraem energia dos nutrientes. Essa energia, na forma de ATP (adenosina trifosfato), é usada para impulsionar todas as funções celulares, desde a síntese de proteínas até o movimento muscular. A eficiência do metabolismo celular depende diretamente da disponibilidade de oxigênio.
Importância do Oxigênio na Respiração Celular
A respiração celular é um processo complexo, mas essencial, onde os organismos extraem energia dos nutrientes, utilizando o oxigênio como aceptor final de elétrons. Este processo é dividido em três etapas principais: glicólise, ciclo de Krebs e cadeia respiratória. O oxigênio é crucial na cadeia respiratória, onde a energia armazenada nos alimentos é convertida em ATP, a moeda energética da célula.
A respiração celular aeróbica, que utiliza oxigênio, é significativamente mais eficiente na produção de ATP do que a respiração anaeróbica, que não o utiliza.
A presença de oxigênio permite que os organismos extraiam uma quantidade muito maior de energia dos nutrientes, garantindo o funcionamento adequado das atividades celulares. A falta de oxigênio pode levar a problemas graves de saúde e até à morte. A necessidade de oxigênio para a respiração celular é fundamental para a sobrevivência de todos os seres vivos.
O Número Atômico e a Tabela Periódica
A Tabela Periódica é uma ferramenta fundamental para organizar e compreender os elementos químicos. A posição de cada elemento na tabela reflete propriedades atômicas e químicas específicas, sendo o número atômico o fator chave para essa organização. Neste tópico, exploraremos a relação intrínseca entre o número atômico e a posição na tabela periódica, bem como a periodicidade das propriedades dos elementos.
Relação Número Atômico e Posição na Tabela
O número atômico de um elemento é definido pelo número de prótons em seu núcleo. Esta propriedade fundamental determina inequivocamente a posição do elemento na tabela periódica. Elementos com o mesmo número atômico ocupam o mesmo lugar, e a ordem crescente dos números atômicos segue a disposição dos elementos na tabela. Por exemplo, o sódio (Na) tem número atômico 11, o que o posiciona no 11º lugar da tabela.
O aumento do número atômico implica um aumento na carga nuclear, o que influencia as propriedades dos elementos e suas interações.
Diagrama da Tabela Periódica
A tabela periódica é organizada em períodos (linhas horizontais) e grupos (colunas verticais). Cada grupo contém elementos com configurações eletrônicas semelhantes, e os elementos em um mesmo período exibem tendências regulares em suas propriedades. A tabela também categoriza os elementos como metais, não metais e semimetais. Os metais geralmente estão localizados na parte esquerda e central da tabela, os não metais na parte direita, e os semimetais em uma faixa entre esses dois grupos.
Elementos de transição são encontrados nos blocos ‘d’ e os lantanídios e actinídios são os elementos que ocupam as duas linhas separadas abaixo da tabela principal.
- Grupos (Famílias): Colunas verticais da tabela, agrupando elementos com propriedades químicas semelhantes, como os metais alcalinos (grupo 1), os halogênios (grupo 17), e os gases nobres (grupo 18). O número do grupo geralmente indica o número de elétrons na camada de valência.
- Períodos: Linhas horizontais da tabela, indicando o número de camadas eletrônicas que os átomos possuem. Os elementos em um mesmo período possuem o mesmo número de níveis de energia.
- Classificação dos Elementos: A tabela categoriza os elementos em metais (condutores de eletricidade e calor), não metais (isoladores ou semicondutores) e semimetais (com propriedades intermediárias). Essa classificação é baseada em suas características químicas e físicas.
- Elementos Representativos: Elementos dos grupos 1, 2, 13, 14, 15, 16, 17 e 18 são considerados elementos representativos. Exemplos incluem o sódio (Na), o oxigênio (O), o cloro (Cl), e o argônio (Ar). Elementos de transição, como o ferro (Fe) e o cobre (Cu), são posicionados entre os grupos 2 e 13.
Estrutura e Disposição dos Elementos
A organização dos elementos na tabela periódica reflete sua estrutura eletrônica. Os elementos são agrupados em blocos (s, p, d, f) com base na última subcamada eletrônica preenchida. O bloco ‘s’ contém os elementos dos grupos 1 e 2, o bloco ‘p’ os elementos dos grupos 13 a 18, o bloco ‘d’ os elementos de transição, e o bloco ‘f’ os lantanídios e actinídios.
A configuração eletrônica influencia diretamente as propriedades químicas e físicas dos elementos, determinando a maneira como eles interagem e formam compostos.
Periodicidade das Propriedades
As propriedades dos elementos mostram padrões periódicos, variando de forma regular ao longo da tabela. Algumas propriedades periódicas importantes incluem eletronegatividade, raio atômico e energia de ionização. A eletronegatividade, por exemplo, tende a aumentar ao longo de um período e diminuir ao longo de um grupo. O raio atômico diminui ao longo de um período e aumenta ao longo de um grupo.
A energia de ionização, necessária para remover um elétron de um átomo, geralmente aumenta ao longo de um período e diminui ao longo de um grupo. Estes padrões são decorrentes da interação entre os elétrons e o núcleo, e da organização dos elétrons nas diferentes camadas e subcamadas. Exemplos concretos de elementos, comparando suas propriedades, mostram como essas tendências periódicas se manifestam.
História do Conhecimento do Oxigênio
A história da compreensão do oxigênio é um testemunho da evolução do pensamento científico, desde as especulações filosóficas antigas até as precisas análises experimentais modernas. A descoberta e a compreensão do papel fundamental do oxigênio na química e na vida moldaram profundamente o desenvolvimento científico e tecnológico ao longo dos séculos.
A Descoberta do Oxigênio e Seu Papel na História da Química
A descoberta do oxigênio não foi obra de um único cientista, mas sim o resultado de um processo gradual de observações, experimentos e refinamento teórico. Diversos pesquisadores contribuíram para a compreensão da natureza do ar e das substâncias que o compunham. Inicialmente, as teorias gregas, como as de Aristóteles, postulavam a existência de quatro elementos fundamentais: terra, água, ar e fogo.
Essas ideias, embora influentes, não eram baseadas em observações sistemáticas e experimentais.
Comparação das Teorias e Hipóteses sobre a Natureza do Oxigênio ao Longo do Tempo
A compreensão da natureza do oxigênio evoluiu significativamente ao longo do tempo. Os alquimistas, embora não tenham compreendido o oxigênio como um elemento separado, realizaram experimentos cruciais que forneceram pistas sobre suas propriedades. Por exemplo, observações de combustão e respiração, apesar de sem uma interpretação correta, ajudaram a formar um cenário para os estudos posteriores. A transição para uma compreensão científica mais rigorosa ocorreu com a obra de cientistas como Priestley e Lavoisier, que desafiaram as teorias anteriores e apresentaram evidências experimentais para uma nova perspectiva.
Principais Cientistas Envolvidos no Estudo do Oxigênio
Diversos cientistas contribuíram para o conhecimento do oxigênio, cada um com suas próprias descobertas e insights.
- Joseph Priestley (1733-1804): Priestley, um clérigo e químico inglês, é creditado com a descoberta do oxigênio em 1774. Através de experimentos com óxido de mercúrio, ele isolou um gás que sustentava a combustão e a respiração com maior eficiência do que o ar comum. Apesar de não ter reconhecido seu papel como um elemento distinto, suas observações foram cruciais para o desenvolvimento do entendimento do oxigênio.
- Carl Wilhelm Scheele (1742-1786): Scheele, um farmacêutico e químico sueco, também isolou o oxigênio independentemente de Priestley, em meados da década de 1770. Suas observações e experimentos foram fundamentais para a compreensão das propriedades do gás, embora suas descobertas tenham sido publicadas um pouco mais tarde.
- Antoine Lavoisier (1743-1794): Lavoisier, um químico francês, foi crucial para a compreensão do papel do oxigênio na combustão e na respiração. Ele refinou os experimentos anteriores, demonstrando que a combustão envolvia a combinação do oxigênio com outras substâncias. Sua obra definitiva foi crucial para a aceitação da teoria moderna sobre a natureza do oxigênio, definindo-o como um elemento fundamental e revolucionando a química.
Linha do Tempo dos Principais Eventos Relacionados ao Oxigênio
A seguinte tabela apresenta uma linha do tempo com os principais eventos relacionados ao conhecimento do oxigênio.
| Data | Evento | Cientistas |
|---|---|---|
| 1774 | Priestley isola o oxigênio. | Joseph Priestley |
| 1774-1777 | Scheele também isola o oxigênio. | Carl Wilhelm Scheele |
| 1777 | Lavoisier publica trabalhos cruciais sobre a combustão e o papel do oxigênio. | Antoine Lavoisier |
| 1789 | Lavoisier publica seu tratado sobre a nomenclatura química, formalizando a compreensão do oxigênio como um elemento. | Antoine Lavoisier |
Conclusões
O desenvolvimento da compreensão do oxigênio é um exemplo inspirador da evolução do pensamento científico. De observações iniciais e teorias filosóficas, a química progrediu para uma compreensão mais precisa e rigorosa baseada em experimentos e evidências. A obra de cientistas como Priestley, Scheele e Lavoisier revolucionou a química e lançou as bases para o desenvolvimento de áreas científicas como a bioquímica e a fisiologia.
Isótopos do Oxigênio
O oxigênio, elemento fundamental para a vida, apresenta diferentes versões atômicas, conhecidas como isótopos. Essas variações, apesar de terem o mesmo número atômico (8), diferem no número de nêutrons em seus núcleos. Compreender os isótopos do oxigênio é crucial para entender suas propriedades e aplicações em diversas áreas da ciência e da tecnologia.
Tipos de Isótopos do Oxigênio
O oxigênio possui três isótopos naturalmente estáveis: oxigênio-16 ( 16O), oxigênio-17 ( 17O) e oxigênio-18 ( 18O). A abundância relativa desses isótopos na natureza influencia as propriedades do oxigênio como um todo.
Abundância Isotópica
A abundância relativa dos isótopos de oxigênio varia levemente, dependendo da amostra analisada. A maior parte do oxigênio encontrado na natureza é o oxigênio-16, representando cerca de 99,76% de sua abundância. O oxigênio-17 e o oxigênio-18 compõem os cerca de 0,04% e 0,20% restantes, respectivamente.
Propriedades Físicas e Químicas
Embora os isótopos de oxigênio tenham propriedades químicas muito semelhantes, devido à semelhança na estrutura eletrônica, pequenas diferenças nas propriedades físicas, como massa atômica e densidade, são observáveis. Essas diferenças, apesar de sutis, podem ser medidas e são importantes em aplicações específicas.
Propriedades e Aplicações
A tabela a seguir resume as propriedades dos diferentes isótopos do oxigênio, destacando as diferenças significativas:
| Isótopo | Símbolo | Número de Prótons | Número de Nêutrons | Massa Atômica (u) | Abundância Natural (%) |
|---|---|---|---|---|---|
| Oxigênio-16 | 16O | 8 | 8 | 15,9949 | 99,76 |
| Oxigênio-17 | 17O | 8 | 9 | 16,9991 | 0,04 |
| Oxigênio-18 | 18O | 8 | 10 | 17,9991 | 0,20 |
As diferenças na massa dos isótopos de oxigênio podem ser aproveitadas em técnicas analíticas, como a espectroscopia de massas, para identificar e quantificar os diferentes isótopos presentes em uma amostra.
Métodos para Determinar o Número Atômico do Oxigênio
Desvendar os segredos da matéria, entender sua composição e propriedades, é um dos pilares da ciência. Determinar o número atômico de um elemento, como o oxigênio, é crucial para compreendê-lo em profundidade. Existem métodos científicos rigorosos que permitem essa determinação precisa. Vamos explorar algumas dessas técnicas.A determinação do número atômico do oxigênio, 8, não foi alcançada de uma única forma.
Ao longo da história da química, diferentes experimentos e observações levaram à compreensão atual sobre a estrutura atômica. Cada método possui suas próprias limitações e aplicações, e a escolha do método dependerá do contexto e dos recursos disponíveis.
Espectroscopia Atômica
A espectroscopia atômica se baseia na interação da luz com os átomos. Quando um átomo é excitado, ele absorve ou emite luz em comprimentos de onda específicos. Esses comprimentos de onda são únicos para cada elemento e podem ser usados para identificá-lo e determinar seu número atômico. Através da análise do espectro, é possível identificar as linhas espectrais características do oxigênio e determinar seu número atômico.
A espectroscopia atômica é amplamente usada em análises químicas e astrofísicas. Um exemplo é a identificação de oxigênio em estrelas distantes, analisando a luz que elas emitem. A técnica envolve a exposição de amostras de oxigênio a uma fonte de energia (como uma chama ou um arco elétrico), que excita os átomos. A luz emitida é então analisada por um espectrômetro, que separa a luz em seus diferentes comprimentos de onda.
Os comprimentos de onda característicos do oxigênio são então comparados a um banco de dados de espectros atômicos conhecidos.
Espectrometria de Massa
A espectrometria de massa é uma técnica poderosa para determinar a composição isotópica de um elemento. O processo envolve a ionização e a separação de íons de diferentes massas. A relação massa-carga dos íons é medida e usada para determinar as diferentes massas isotópicas do oxigênio. Isso permite identificar os isótopos do oxigênio e, consequentemente, estabelecer o número atômico.
O oxigênio possui três isótopos estáveis: 16O, 17O e 18O. A espectrometria de massa, através da análise da abundância relativa desses isótopos, contribui para a compreensão da estrutura atômica do oxigênio. A técnica envolve a ionização da amostra de oxigênio, separando os íons em função de sua relação massa-carga, e a detecção desses íons.
Os picos obtidos no espectro de massa correspondem aos diferentes isótopos e suas abundâncias relativas.
Determinação Química
A determinação química do número atômico do oxigênio pode ser feita através de reações químicas específicas. O oxigênio, ao reagir com outros elementos, apresenta comportamentos característicos. Por exemplo, a formação de óxidos específicos, com diferentes proporções estequiométricas, pode ser usada para determinar o número de átomos de oxigênio envolvidos. Combinando a proporção de elementos em compostos químicos com as leis da química, como a lei das proporções definidas, é possível deduzir o número atômico do oxigênio.
Guia Passo a Passo para Determinar o Número Atômico do Oxigênio (Exemplo usando Espectroscopia Atômica)
- Colete uma amostra de oxigênio em um recipiente apropriado.
- Exponha a amostra a uma fonte de energia para excitar os átomos.
- Utilize um espectrômetro para analisar a luz emitida pela amostra.
- Identifique os comprimentos de onda característicos do oxigênio no espectro obtido.
- Compare esses comprimentos de onda com um banco de dados de espectros atômicos para determinar o número atômico.
Aplicações em Ciências da Vida: Qual É O Número Atômico Do Oxigênio
O oxigênio, elemento fundamental para a vida na Terra, desempenha papéis cruciais em inúmeras reações biológicas. Seu número atômico, 8, define sua identidade química e, consequentemente, sua participação em processos vitais. A biologia molecular e a bioquímica se beneficiam profundamente do entendimento detalhado das propriedades e funções do oxigênio. Vamos explorar como este elemento vital impacta os processos biológicos e suas aplicações em diferentes áreas de pesquisa.
Funções do Oxigênio em Processos Biológicos
O oxigênio é essencial para a respiração celular, o processo crucial que fornece energia às células. Nesse processo, o oxigênio atua como o aceptor final de elétrons na cadeia respiratória, impulsionando a produção de ATP, a moeda energética da célula. A presença de oxigênio é fundamental para a manutenção da vida e o funcionamento de organismos complexos.
Importância do Oxigênio para a Vida na Terra
O oxigênio é vital para a existência da vida na Terra, sendo o componente fundamental de moléculas essenciais como a água (H₂O) e o dióxido de carbono (CO₂). A presença de oxigênio na atmosfera possibilitou o surgimento e a evolução de organismos aeróbicos, que utilizam o oxigênio para obter energia. Sem o oxigênio, a vida como a conhecemos não seria possível.
Aplicações em Biologia Molecular e Bioquímica
O oxigênio está envolvido em inúmeras reações bioquímicas, incluindo a síntese de proteínas e ácidos nucleicos. A compreensão detalhada dessas reações é crucial para o desenvolvimento de novas terapias e tecnologias em biologia molecular e bioquímica. Por exemplo, a análise da produção de radicais livres, derivados do oxigênio, é fundamental para entender o processo de envelhecimento e doenças como o câncer.
Exemplos de Pesquisas Científicas Relacionadas ao Oxigênio
Diversas pesquisas científicas investigam o papel do oxigênio em diferentes processos biológicos. Um exemplo é o estudo do metabolismo do oxigênio em bactérias, que pode fornecer insights valiosos para o desenvolvimento de novas estratégias para combater infecções. Outro exemplo é a investigação das propriedades antioxidantes de compostos orgânicos, que podem auxiliar no combate aos danos causados pelos radicais livres derivados do oxigênio.
Comparação das Funções do Oxigênio em Diferentes Processos Biológicos
O oxigênio desempenha funções distintas em diferentes processos biológicos. Na respiração celular, o oxigênio é essencial para a produção de energia. No entanto, em outros processos, como a síntese de hormônios, o oxigênio pode ter um papel menos direto. A compreensão das nuances dessas funções é crucial para o avanço da biologia.
Aplicações em Ciências da Terra
Source: manualdaquimica.com
O oxigênio, elemento fundamental para a vida na Terra, desempenha um papel crucial em diversos processos geológicos, influenciando a formação de rochas, minerais e a própria atmosfera. Sua presença molda o ambiente terrestre, desde as profundezas da crosta até as camadas mais elevadas da atmosfera. Compreender as reações químicas envolvendo o oxigênio é essencial para desvendar os segredos da história geológica do nosso planeta.O número atômico do oxigênio, 8, impacta diretamente suas propriedades químicas e físicas.
A capacidade de formar ligações covalentes e participar de reações de oxidação e redução o tornam um elemento essencial para entender processos geológicos. A abundância do oxigênio na atmosfera, por exemplo, influencia diretamente a temperatura global e a formação de nuvens, além de ser um agente oxidante fundamental em diversos ciclos biogeoquímicos.
Número Atômico do Oxigênio e suas Aplicações
O número atômico do oxigênio (8) influencia suas propriedades químicas, como sua alta eletronegatividade e tendência a formar ligações covalentes. Essas propriedades são fundamentais em reações de oxidação e redução, que são essenciais para diversos processos geológicos. A formação de óxidos minerais, por exemplo, depende da capacidade do oxigênio de reagir com outros elementos, como ferro e silício. Reações de oxidação em processos geológicos, como a oxidação de minerais ferrosos, são fortemente influenciadas pela disponibilidade de oxigênio.
A presença de oxigênio na atmosfera também afeta a temperatura global, pois absorve e libera energia durante reações de oxidação e redução.
Importância do Oxigênio na Formação de Rochas e Minerais
O oxigênio desempenha um papel crucial na formação e transformação de diferentes tipos de rochas e minerais. Nas rochas ígneas, a presença de oxigênio influencia a cristalização dos minerais, e a oxidação de minerais ferrosos pode ocorrer durante o resfriamento do magma. Nas rochas metamórficas, a presença ou ausência de oxigênio pode afetar a estabilidade dos minerais. Nas rochas sedimentares, o oxigênio participa de reações de oxidação que alteram a composição mineralógica, como a formação de óxidos de ferro e a decomposição de minerais silicáticos.
A presença de oxigênio também afeta a estabilidade e a decomposição dos minerais. Reações químicas como a formação de carbonatos e a oxidação de minerais também são influenciadas pela disponibilidade de oxigênio.
Exemplo Prático do Estudo da Atmosfera
Um exemplo prático de estudo da atmosfera utilizando o oxigênio é o monitoramento da concentração de oxigênio em diferentes altitudes. O método científico envolve o uso de sensores que medem a concentração de oxigênio em amostras de ar coletadas em diferentes altitudes. As variáveis mensuradas incluem a pressão atmosférica, a temperatura e a concentração de oxigênio. Os resultados obtidos podem revelar padrões de variação na concentração de oxigênio em relação à altitude, fornecendo informações sobre a composição atmosférica e a dinâmica da atmosfera.
Esses dados podem ter implicações importantes na compreensão do clima global e da distribuição de gases na atmosfera.
Estudos Científicos Relacionados ao Oxigênio
Vários estudos científicos investigam o papel do oxigênio em Ciências da Terra. Um exemplo é o estudo da evolução da concentração de oxigênio na atmosfera ao longo do tempo. Autores como [Autor 1] e [Autor 2], no artigo “[Título do Artigo]”, publicado no periódico “[Periódico Científico]”, analisaram dados geológicos para demonstrar como a concentração de oxigênio na atmosfera mudou ao longo de milhões de anos.
Os resultados sugerem que a evolução da atmosfera foi profundamente influenciada pela disponibilidade de oxigênio, e as mudanças na concentração de oxigênio afetaram a vida na Terra. Outros estudos podem incluir o papel do oxigênio na formação de rochas sedimentares e a influência da concentração de oxigênio em diferentes ambientes geológicos.
Número Atômico e Reações Químicas
O número atômico, que representa o número de prótons no núcleo de um átomo, desempenha um papel crucial na determinação da reatividade química de um elemento. No caso do oxigênio, seu número atômico 8 influencia diretamente sua estrutura eletrônica, configurando suas interações com outros elementos e, consequentemente, suas reações químicas. Compreender essa relação é fundamental para prever e explicar os comportamentos químicos do oxigênio.
Influência do Número Atômico na Reatividade do Oxigênio, Qual É O Número Atômico Do Oxigênio
A estrutura eletrônica do oxigênio, com 8 prótons e 8 elétrons, influencia sua reatividade. A configuração eletrônica do oxigênio é 1s 22s 22p 4. Essa configuração, com dois elétrons desemparelhados na camada de valência (2p), permite que o oxigênio forme ligações químicas com outros elementos para atingir a estabilidade. A necessidade de adquirir dois elétrons para completar a camada de valência torna o oxigênio um elemento altamente eletronegativo.A alta eletronegatividade do oxigênio impulsiona sua reatividade.
Ele tende a atrair elétrons de outros átomos, formando ligações covalentes ou iônicas. Essa característica o torna um elemento fundamental em inúmeras reações químicas, como a combustão. Em contraste, o nitrogênio, com número atômico 7, tem uma configuração eletrônica que o torna menos reativo que o oxigênio, enquanto o flúor, com número atômico 9, é ainda mais reativo que o oxigênio devido à sua maior eletronegatividade.
Esta comparação demonstra a influência direta do número atômico na reatividade química.
Comparação das Reações do Oxigênio com Outros Elementos
O oxigênio demonstra diferentes padrões de reatividade com diversos elementos, dependendo de suas respectivas eletronegatividades e tendências de formação de ligações.
- Metais Alcalinos: Reações vigorosas, formando óxidos iônicos. O oxigênio, mais eletronegativo, retira elétrons dos metais alcalinos, criando ligações iônicas fortes. A reação é frequentemente exotérmica, liberando grande quantidade de energia na forma de calor. Exemplo: 2Na(s) + O 2(g) → Na 2O 2(s)
- Metais de Transição: Reações variáveis, formando óxidos e outros compostos complexos. A reatividade depende do metal específico e das condições da reação. Podem ocorrer reações de oxidação, formando óxidos metálicos, como Fe 2O 3. A formação de óxidos de metais de transição frequentemente envolve reações de transferência de elétrons, formando ligações iônicas ou covalentes.
- Halogênios: Reações menos comuns. O oxigênio e os halogênios podem formar compostos específicos, mas sua reatividade relativa depende das condições de reação.
| Elemento | Tipo de Reação | Produto(s) | Condições |
|---|---|---|---|
| Metais Alcalinos | Combustão | Óxidos | Temperatura ambiente, presença de oxigênio |
| Metais de Transição | Oxidação | Óxidos metálicos | Temperatura elevada, presença de oxigênio |
| Halogênios | Reação de Deslocamento | Compostos específicos | Condições específicas para cada reação |
Principais Reações Químicas Envolvendo o Oxigênio
O oxigênio participa de diversas reações químicas importantes, como a combustão, oxidação e formação de óxidos.
| Reação | Reagentes | Produtos | Condições |
|---|---|---|---|
| Combustão | Metano + Oxigênio | Dióxido de Carbono + Água | Temperatura elevada |
| Combustão | Hidrogênio + Oxigênio | Água | Temperatura elevada |
| Formação de Óxido | Ferro + Oxigênio | Óxido de Ferro | Temperatura elevada |
Condições Necessárias para as Reações Químicas
As condições de reação, como temperatura, pressão e presença de catalisadores, afetam a velocidade e o rendimento das reações químicas envolvendo o oxigênio.
Reatividade do Oxigênio: Uma Visão Geral
A reatividade do oxigênio, como elemento com número atômico 8, é determinada pela sua estrutura eletrônica, que influencia sua capacidade de formar ligações químicas. Sua alta eletronegatividade impulsiona sua participação em diversas reações com outros elementos, como metais alcalinos, metais de transição e halogênios. As reações variam de combustões energéticas a formações de óxidos específicos, dependendo das condições de temperatura, pressão e presença de catalisadores.
Concluindo nossa jornada pelo número atômico do oxigênio, vimos como esse pequeno número 8 impacta o mundo ao nosso redor. Do seu papel vital na respiração celular à sua participação em processos geológicos, o oxigênio se revela um elemento multifacetado e essencial para a manutenção da vida e a formação de nosso planeta. Espero que tenha sido uma leitura envolvente e esclarecedora!
Qual a diferença entre oxigênio molecular (O2) e oxigênio atômico (O)?
O oxigênio molecular (O 2) é a forma mais comum e estável do oxigênio, enquanto o oxigênio atômico (O) é menos estável e mais reativo. A diferença está na estrutura molecular, com o O 2 formado por duas moléculas e o O por apenas uma.
Quais são os principais isótopos do oxigênio?
Os principais isótopos do oxigênio são o 16O, o 17O e o 18O. Eles diferem no número de nêutrons, mas compartilham o mesmo número de prótons (8).
Como o oxigênio é importante para a respiração celular?
O oxigênio é o aceptor final de elétrons na respiração celular, permitindo a liberação de energia dos nutrientes. Sem ele, a respiração celular não seria possível, o que impacta diretamente a produção de energia em organismos aeróbicos.
Quais são as principais aplicações do oxigênio na indústria?
O oxigênio é utilizado em diversos processos industriais, como soldagem, corte de metais, produção de aço e combustão em fornos. Sua capacidade de oxidar materiais é fundamental nesses contextos.