Qual Numero Atomico Do Oxigenio – Qual Número Atômico do Oxigênio? Prepare-se para uma aventura fascinante pelo mundo dos átomos! Vamos desvendar o mistério por trás do número atômico do oxigênio, um elemento crucial para a vida na Terra, e explorar suas aplicações em diversas áreas. Descubra como esse número, tão simples quanto 8, influencia as propriedades e o comportamento do oxigênio, desde sua reatividade até sua presença essencial em processos biológicos e industriais.
O oxigênio, com seu número atômico 8, desempenha um papel fundamental em inúmeros processos químicos e biológicos. Sua presença é essencial para a respiração, a combustão e a fotossíntese, dentre outros. A compreensão de seu número atômico nos permite prever e entender seu comportamento em diferentes contextos, revelando um universo de aplicações práticas e teóricas.
Introdução ao Número Atômico do Oxigênio
Olá, exploradores da ciência! Preparem-se para desvendar os segredos por trás do número atômico do oxigênio, um elemento fundamental para a vida como a conhecemos. Vamos mergulhar no fascinante mundo da tabela periódica e descobrir por que o oxigênio ocupa o lugar que ocupa. Preparem suas mentes para uma jornada cheia de descobertas!O número atômico de um elemento químico é a quantidade de prótons presentes em seu núcleo atômico.
Essa propriedade fundamental define a identidade do elemento e sua posição na tabela periódica. Cada elemento possui um número atômico único, como uma espécie de “código de barras” que o diferencia de todos os outros.
Definição do Número Atômico
O número atômico de um elemento químico corresponde ao número de prótons presentes em seu núcleo atômico. Este número é fundamental para identificar e categorizar os elementos na tabela periódica. Em termos simples, é a “assinatura” de um elemento.
Importância do Número Atômico na Identificação dos Elementos Químicos
O número atômico desempenha um papel crucial na identificação dos elementos químicos, pois cada elemento possui um número atômico único. Essa singularidade permite a diferenciação entre elementos, como o oxigênio e o carbono, que possuem propriedades químicas e físicas distintas. Imagine um código de barras para cada elemento, permitindo que os cientistas identifiquem e classifiquem facilmente os átomos.
Posição do Oxigênio na Tabela Periódica
O oxigênio, com número atômico 8, está localizado no grupo 16 (anteriormente grupo VI A) e no período 2 da tabela periódica. Sua posição na tabela reflete as propriedades químicas do elemento, indicando a sua tendência a formar ligações químicas. Visualize a tabela periódica como um mapa, onde cada elemento ocupa uma posição específica, com base em seu número atômico e configuração eletrônica.
Estrutura Atômica do Oxigênio
O átomo de oxigênio possui 8 prótons, 8 nêutrons (em seu isótopo mais comum) e 8 elétrons. Os elétrons orbitam o núcleo em camadas, ou níveis de energia. Sua estrutura atômica influencia diretamente as propriedades químicas do oxigênio, como sua capacidade de formar ligações covalentes e suas reações químicas.
Organização da Tabela Periódica para Destacar o Oxigênio
A tabela periódica organiza os elementos de forma lógica, agrupando-os por semelhanças em suas propriedades. O oxigênio, por exemplo, encontra-se no grupo dos calcogênios, caracterizado por sua capacidade de formar compostos com outros elementos. A tabela periódica, assim, é uma ferramenta fundamental para entender as relações entre os elementos e prever as suas propriedades.
| Elemento | Número Atômico | Grupo | Período |
|---|---|---|---|
| Oxigênio | 8 | 16 | 2 |
O número atômico é a chave para entender a organização e as propriedades dos elementos químicos.
Determinação do Número Atômico do Oxigênio
A jornada para compreender a estrutura atômica do oxigênio, e consequentemente, determinar seu número atômico, foi um processo fascinante que envolveu avanços científicos ao longo de séculos. Desvendando os segredos da matéria, os cientistas se aproximaram da compreensão da composição fundamental da natureza.
Métodos Históricos de Determinação
Nos primórdios da química, a determinação do número atômico era uma tarefa complexa, sem os instrumentos sofisticados disponíveis hoje. Os métodos históricos se baseavam em experimentos químicos e análises quantitativas das reações envolvendo o oxigênio. A observação cuidadosa das proporções em que o oxigênio reagia com outros elementos fornecia pistas valiosas sobre sua composição.
Métodos Modernos e Comparação com os Históricos
A comparação entre os métodos históricos e os modernos revela uma evolução significativa na compreensão da estrutura atômica. Enquanto os métodos históricos dependiam de experimentos químicos e relações ponderais, os métodos modernos se baseiam na estrutura atômica e em instrumentos de alta precisão, como espectroscópios. A precisão e o detalhamento obtidos nos métodos modernos são muito superiores aos históricos, permitindo uma compreensão mais profunda da composição elementar.
Determinação do Número Atômico a Partir da Estrutura Atômica
O número atômico, que representa o número de prótons no núcleo de um átomo, é fundamental para a organização da tabela periódica e para entender as propriedades químicas dos elementos. A estrutura atômica, com seu núcleo contendo prótons e nêutrons, e elétrons orbitando o núcleo, fornece a base para a determinação do número atômico. A análise espectroscópica, que detecta a interação da luz com a matéria, permite a identificação das características únicas de cada elemento, revelando o número atômico.
Experimentos que Levaram à Descoberta do Número Atômico do Oxigênio
Diversos experimentos contribuíram para a compreensão da estrutura atômica do oxigênio e, consequentemente, para a determinação de seu número atômico. A análise das emissões espectrais do oxigênio, utilizando técnicas espectroscópicas, forneceu dados cruciais para a identificação dos níveis de energia dos átomos de oxigênio. Através da medição precisa das emissões de luz, foi possível identificar a assinatura única do oxigênio, levando à determinação de seu número atômico.
Dados Experimentais para a Determinação
| Experimento | Observações | Dados |
|---|---|---|
| Espectroscopia Atômica do Oxigênio | Análise das linhas espectrais emitidas pelo oxigênio | Linhas espectrais características, identificando a assinatura do oxigênio. |
| Experimentos de Descarga Elétrica em Gases | Observação do comportamento do oxigênio sob descarga elétrica | Emissão de luz em diferentes comprimentos de onda, revelando informações sobre a estrutura atômica. |
A análise desses dados experimentais, considerando as teorias atômicas da época, permitiu a determinação do número atômico do oxigênio. Os valores obtidos concordam com as observações de reações químicas e propriedades físicas do elemento.
Propriedades do Oxigênio Relacionadas ao Número Atômico
O número atômico do oxigênio, 8, é a chave para entender suas propriedades únicas. Ele dita a estrutura do átomo, influenciando como ele se comporta quimicamente e interage com outros elementos. Imagine o número atômico como a identidade do oxigênio, revelando suas características essenciais.O número atômico, ao definir o número de prótons no núcleo, determina o número de elétrons na eletrosfera.
Essa configuração eletrônica é crucial para compreender as tendências de reatividade e a forma como o oxigênio se liga a outros elementos. A distribuição eletrônica do oxigênio, consequentemente, define sua capacidade de ganhar elétrons, formando ligações químicas, e sua tendência a reagir com outras substâncias.
Relação entre Número Atômico e Propriedades Químicas
O número atômico 8 do oxigênio, com seus 8 prótons, determina a sua posição na tabela periódica e sua família. Isso, por sua vez, influencia diretamente as suas propriedades químicas. A configuração eletrônica do oxigênio, com 6 elétrons na camada de valência, o torna um elemento altamente reativo, buscando alcançar a estabilidade através da formação de ligações químicas. Essa busca pela estabilidade impacta sua reatividade e as formas como ele se combina com outros elementos.
Ligação Química do Oxigênio
O oxigênio, com sua alta eletronegatividade, forma ligações covalentes com outros elementos. Ele tem uma tendência natural a ganhar dois elétrons para atingir a estabilidade, formando ligações iônicas ou covalentes, dependendo do elemento com o qual se combina. Um exemplo clássico é a formação de água (H₂O), onde o oxigênio compartilha elétrons com dois átomos de hidrogênio. Essa ligação covalente é fundamental para as propriedades da água e para a vida na Terra.
Reatividade do Oxigênio
A alta reatividade do oxigênio é uma consequência direta de sua configuração eletrônica. Sua necessidade de ganhar dois elétrons para completar a camada de valência o torna um oxidante forte. Isso significa que ele pode retirar elétrons de outros átomos, levando a reações químicas rápidas e frequentemente exotérmicas, como a combustão. A reação do oxigênio com combustíveis libera uma grande quantidade de energia, evidenciando sua alta reatividade.
Comparação da Reatividade com Outros Elementos da Família
Na família dos calcogênios, o oxigênio apresenta uma reatividade considerável. Comparado a elementos como o enxofre ou o selênio, o oxigênio exibe uma reatividade ligeiramente maior, devido à sua alta eletronegatividade. A diferença na reatividade reflete as nuances na configuração eletrônica dos elementos da família. Por exemplo, o enxofre forma ligações com uma gama maior de elementos em comparação ao oxigênio, mas a reatividade geral é similar.
Importância do Número Atômico para Prever o Comportamento do Oxigênio
Conhecer o número atômico do oxigênio é crucial para prever seu comportamento químico. Sabendo que o oxigênio tem 8 prótons, podemos prever que ele formará ligações covalentes e que sua reatividade será alta. Isso nos permite entender e até mesmo controlar reações químicas envolvendo o oxigênio, com aplicações práticas em indústrias e em processos biológicos.
Aplicações do Número Atômico do Oxigênio (Número Atômico 8)
O oxigênio, elemento fundamental com número atômico 8 (8 prótons e 8 elétrons), desempenha um papel crucial em inúmeras aplicações científicas e tecnológicas. Sua alta reatividade, consequência de sua estrutura eletrônica, o torna essencial em processos de combustão, respiração e inúmeras outras reações químicas. Compreender a relação entre seu número atômico e suas propriedades é fundamental para apreciar sua importância em diferentes contextos.
Aplicações Gerais
O oxigênio (O 2) é amplamente utilizado em diversas áreas, desde a respiração humana até processos industriais. Sua presença é essencial em reações de combustão, como a queima de combustíveis fósseis em motores de combustão interna, fornecendo a energia necessária para o funcionamento desses sistemas. A soldagem também depende da combustão, utilizando o oxigênio para atingir altas temperaturas e fundir metais.
A respiração artificial em situações de emergência e a produção de aço são outros exemplos notáveis de aplicações gerais do oxigênio.
Processos Químicos
O número atômico do oxigênio, 8, influencia diretamente suas propriedades químicas. A presença de seis elétrons na camada de valência faz com que o oxigênio seja altamente reativo, formando ligações covalentes com outros elementos. Essa alta reatividade é a base para a formação de óxidos, compostos que resultam da combinação do oxigênio com outros elementos químicos. A combustão, por exemplo, envolve a reação do oxigênio com combustíveis, liberando energia na forma de calor e luz.
A reação com metais também é característica do oxigênio, levando à formação de óxidos metálicos, como a ferrugem (óxido de ferro).
Aplicações na Medicina
O oxigênio é essencial na medicina, atuando como suporte vital em situações de emergência. A terapia com oxigênio é empregada para tratar diversas doenças respiratórias, como asma e enfisema, e para auxiliar pacientes com insuficiência respiratória. A administração de oxigênio pode ser realizada por meio de cilindros, máscaras faciais ou outros dispositivos, com diferentes fluxos e concentrações, dependendo da necessidade do paciente.
É importante destacar as precauções necessárias no uso de oxigênio, como evitar materiais inflamáveis nas proximidades dos equipamentos, para prevenir riscos de incêndio.
Aplicações na Indústria
O oxigênio desempenha um papel fundamental em processos industriais, como a produção de aço, onde é utilizado para auxiliar na combustão dos combustíveis e remover impurezas. A utilização de oxigênio puro, em comparação com o ar atmosférico, permite maior eficiência em diversos processos, devido à concentração mais alta do elemento. A produção de metanol, a síntese de produtos químicos orgânicos, o tratamento de efluentes e a combustão em fornos industriais são outras aplicações importantes do oxigênio na indústria.
Importância para a Vida na Terra
O oxigênio é essencial para a vida na Terra. A fotossíntese, processo realizado por plantas e algas, é responsável pela produção de oxigênio na atmosfera. A respiração celular, processo realizado por todos os seres vivos aeróbicos, utiliza o oxigênio para liberar energia das moléculas orgânicas. O equilíbrio do ciclo do oxigênio é fundamental para a manutenção da vida, assegurando a disponibilidade adequada deste elemento vital para todos os organismos.
Comparação de Aplicações
Embora o oxigênio seja essencial em diferentes áreas, suas aplicações apresentam nuances. Na medicina, a administração de oxigênio é regulada e controlada para atender às necessidades específicas do paciente. Na indústria, a utilização de oxigênio puro é otimizada para maximizar a eficiência dos processos. Em ambas as áreas, a segurança e o controle rigoroso são fundamentais. As quantidades de oxigênio utilizadas também variam significativamente, dependendo da aplicação e do contexto.
Número Atômico e Isótopos do Oxigênio
Esta seção mergulha no fascinante mundo dos isótopos do oxigênio, explorando suas propriedades, diferenças e aplicações. Compreender os isótopos é fundamental, pois, apesar das variações, o número atômico do oxigênio permanece constante.
Definição de Isótopos
Isótopos são átomos de um mesmo elemento que possuem o mesmo número de prótons, mas diferentes números de nêutrons. Imagine dois irmãos gêmeos: ambos compartilham a mesma essência (número de prótons), mas podem ter pesos diferentes (número de nêutrons) devido a diferentes experiências ao longo da vida. O oxigênio-16, o oxigênio-17 e o oxigênio-18 são exemplos de isótopos de oxigênio, todos com 8 prótons, mas com diferentes quantidades de nêutrons.
Impacto dos Isótopos no Número Atômico do Oxigênio
Os isótopos do oxigênio não alteram o número atômico do elemento, pois o número atômico é definido pelo número de prótons no núcleo do átomo. O oxigênio, por definição, possui 8 prótons. A presença de mais ou menos nêutrons não modifica essa característica fundamental que define a identidade do elemento. A estrutura atômica do oxigênio mostra um núcleo com 8 prótons e um número variável de nêutrons, dependendo do isótopo.
O número atômico é o que define o elemento químico.
Comparação das Propriedades Químicas dos Isótopos do Oxigênio
As propriedades químicas dos isótopos do oxigênio são praticamente idênticas. As pequenas diferenças em massa atômica causam variações mínimas nas propriedades químicas. Por exemplo, as velocidades de reação em nível molecular podem ser levemente afetadas, mas a maioria das reações químicas permanece inalterada. Apesar disso, as propriedades físicas, como ponto de fusão, ebulição e densidade, podem apresentar pequenas diferenças.
Essas pequenas diferenças são insignificantes no contexto da química cotidiana.
Tabela de Isótopos do Oxigênio
| Isótopo | Símbolo | Número de Prótons | Número de Nêutrons | Massa Atômica (u) | Abundância Natural (%) |
|---|---|---|---|---|---|
| Oxigênio-16 | ¹⁶O | 8 | 8 | ~15,9949 | ~99,76% |
| Oxigênio-17 | ¹⁷O | 8 | 9 | ~16,9991 | ~0,037% |
| Oxigênio-18 | ¹⁸O | 8 | 10 | ~17,9991 | ~0,20% |
A tabela acima demonstra os diferentes isótopos do oxigênio, suas respectivas massas atômicas e suas abundâncias na natureza. A abundância natural representa a proporção relativa de cada isótopo no oxigênio natural.
Identificação dos Isótopos do Oxigênio
Os isótopos do oxigênio são identificados e separados utilizando técnicas como a espectroscopia de massa. Nesse método, os íons são acelerados e desviados por um campo magnético, separando-os com base em suas massas. Esta técnica permite determinar a composição isotópica de uma amostra. Exemplos de aplicações práticas incluem análises geológicas, estudos ambientais e na medicina nuclear.
Representação Visual do Número Atômico do Oxigênio
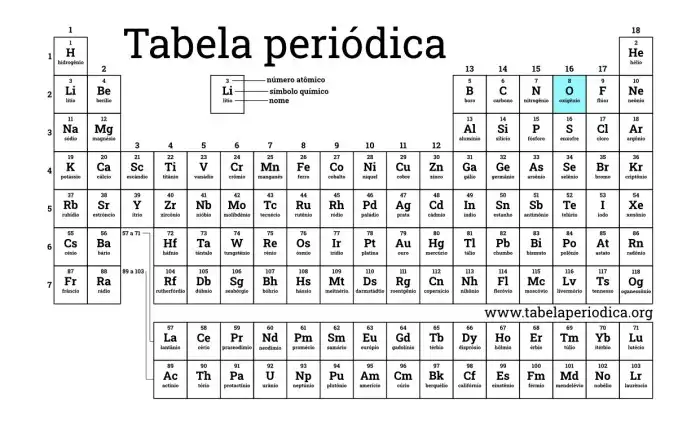
Source: tabelaperiodica.org
O número atômico de um elemento químico, como o oxigênio, é fundamental para entender sua identidade e propriedades. Ele fornece informações cruciais sobre a estrutura atômica e a posição do elemento na tabela periódica. Compreender essas relações permite prever e explicar as propriedades químicas e físicas do oxigênio.O oxigênio, um elemento vital para a vida na Terra, desempenha um papel crucial em inúmeros processos biológicos e químicos.
Sua presença na atmosfera e em moléculas essenciais, como a água, demonstra sua importância na manutenção da vida. A compreensão do número atômico do oxigênio nos permite compreender melhor suas reações e aplicações em diversos contextos.
Tabela do Oxigênio
A tabela a seguir apresenta as principais características do oxigênio, incluindo seu símbolo, número atômico, massa atômica e configuração eletrônica. A organização precisa dessas informações é crucial para a compreensão do elemento.
| Coluna | Descrição | Exemplo |
|---|---|---|
| Símbolo | Abreviação do elemento | O |
| Número Atômico | Quantidade de prótons no núcleo | 8 |
| Massa Atômica | Massa média dos átomos de oxigênio | 15,999 u |
| Configuração Eletrônica | Distribuição dos elétrons por níveis de energia | 1s22s22p4 |
Posição na Tabela Periódica
O oxigênio (O) está localizado no grupo 16 e no período 2 da tabela periódica. Sua posição reflete suas propriedades químicas e sua relação com outros elementos. A tabela periódica organiza os elementos de acordo com suas propriedades e estruturas eletrônicas, permitindo previsões sobre o comportamento químico. A posição do oxigênio na tabela periódica é fundamental para entender suas reações e aplicações.
[Inserir imagem da tabela periódica com o oxigênio destacado aqui – Descrição da imagem: Imagem da tabela periódica mostrando o elemento oxigênio destacado, com sua localização no grupo 16 e período 2.]
Estrutura Atômica do Oxigênio
O átomo de oxigênio possui 8 prótons no núcleo, que são partículas com carga positiva. O número de prótons define a identidade do elemento. O núcleo também contém nêutrons, partículas sem carga. Em torno do núcleo, os elétrons, partículas com carga negativa, orbitam em níveis de energia. A configuração eletrônica 1s 22s 22p 4 indica a distribuição dos elétrons nesses níveis de energia.
[Inserir diagrama da estrutura atômica do oxigênio aqui – Descrição do diagrama: Diagrama mostrando o núcleo do átomo de oxigênio com 8 prótons e nêutrons, e elétrons em órbitas ao redor do núcleo, indicando os níveis de energia. As cores devem ser usadas para diferenciar prótons, nêutrons e elétrons.]
Relação Número Atômico x Número de Prótons
O número atômico de um elemento é equivalente ao número de prótons em seu núcleo. Essa relação direta define a identidade do elemento. Um átomo de oxigênio, com número atômico 8, possui 8 prótons. [Inserir diagrama da relação número atômico x número de prótons aqui – Descrição do diagrama: Diagrama simples mostrando a correspondência entre o número atômico e o número de prótons, utilizando setas para ilustrar a relação.]
Importância do Oxigênio
O oxigênio é um elemento essencial para a vida na Terra. É fundamental para a respiração de organismos aeróbicos e desempenha um papel crucial em diversas reações químicas. Sua presença na atmosfera é vital para a manutenção da vida. O oxigênio é usado em diversas aplicações industriais, como na produção de aço e na medicina, como suporte respiratório.
Comparação com Outros Elementos

Source: com.br
O oxigênio, com seu número atômico 8, desempenha um papel crucial em inúmeras reações químicas e processos biológicos. Compreender suas propriedades em comparação com outros elementos da mesma família e período fornece insights valiosos sobre as tendências periódicas e como essas tendências afetam as características dos elementos. Esta análise permite uma compreensão mais aprofundada da posição do oxigênio no universo dos elementos químicos.
Seleção de Elementos
Para uma comparação eficaz, foram selecionados elementos da família dos calcogênios (grupo 16 da tabela periódica), incluindo enxofre, selênio, telúrio e polônio, e três elementos do mesmo período (período 2), incluindo carbono, nitrogênio e flúor. A escolha desses elementos permite observar as tendências periódicas que governam o comportamento químico.
Comparação de Propriedades
- Número Atômico: O número atômico reflete o número de prótons no núcleo atômico. Os valores para cada elemento selecionado são demonstrados na tabela comparativa.
- Configuração Eletrônica: A distribuição dos elétrons em camadas e subcamadas atômicas é crucial para entender o comportamento químico. As configurações eletrônicas dos elementos afetam diretamente as propriedades químicas. A tabela comparativa detalha a configuração eletrônica de cada elemento.
- Eletronegatividade: A eletronegatividade mede a tendência de um átomo de atrair elétrons em uma ligação química. O oxigênio, por exemplo, é um elemento altamente eletronegativo, como se pode observar na tabela comparativa.
- Eletropositividade: A eletropositividade, o inverso da eletronegatividade, mede a tendência de um átomo perder elétrons. A eletropositividade dos elementos da família dos calcogênios, por exemplo, decresce de cima para baixo na tabela periódica, conforme detalhado na tabela comparativa.
- Raio Atômico: O raio atômico é a medida do tamanho de um átomo. A tabela comparativa demonstra como o raio atômico varia dentro da família dos calcogênios e em função do período.
- Ponto de Fusão e Ebulição: Os pontos de fusão e ebulição fornecem insights sobre as forças intermoleculares. A tabela comparativa mostra como esses pontos variam com a posição do elemento na tabela periódica.
- Estado Físico (25°C e 1 atm): A temperatura e pressão padrão afetam o estado físico de um elemento. A tabela comparativa apresenta o estado físico de cada elemento sob essas condições.
- Densidade: A densidade, medida da massa por unidade de volume, é afetada pelo raio atômico e pela estrutura eletrônica. A tabela comparativa mostra a densidade de cada elemento.
- Reações Químicas: Os elementos da família dos calcogênios, como o oxigênio, são frequentemente encontrados em reações de oxidação. A tabela comparativa detalha as reações químicas típicas de cada elemento.
- Compostos Mais Importantes: A formação de compostos reflete as propriedades químicas dos elementos. A tabela comparativa inclui exemplos de compostos importantes para cada elemento.
Tabela Comparativa
História da Descoberta do Oxigênio
A descoberta do oxigênio, um elemento fundamental para a vida na Terra, foi um processo gradual e envolveu contribuições de diversos cientistas ao longo de séculos. Este percurso científico não apenas revelou a existência deste gás vital, mas também moldou o desenvolvimento da química moderna. A busca pela compreensão da combustão e da respiração foi crucial para esse avanço.A compreensão da natureza do ar e sua participação nos processos químicos era incipiente na época.
A descoberta do oxigênio foi resultado de uma busca incansável por respostas a essas questões, e a história reflete as nuances da ciência em desenvolvimento.
Principais Fases da Descoberta
A descoberta do oxigênio foi um processo que envolveu várias etapas e personagens. A compreensão do papel do ar na combustão e respiração evoluiu ao longo do tempo, com a descoberta do oxigênio representando um marco crucial nesse desenvolvimento.
Desenvolvimento dos Métodos de Análise
Os primeiros métodos para análise química eram rudimentares em comparação com os instrumentos sofisticados de hoje. Inicialmente, a observação de fenômenos como a combustão e a respiração era a principal fonte de informação. A evolução dos métodos de análise, desde técnicas simples até os experimentos mais elaborados, permitiu que os cientistas compreendessem a composição do ar e a função do oxigênio em processos químicos.
Isso foi fundamental para o avanço do conhecimento.
Contribuições de Cientistas Importantes
- Robert Boyle (século XVII): Realizou experimentos com ar comprimido e sua influência nos processos de combustão. Suas observações, embora não conduzissem diretamente à descoberta do oxigênio, foram cruciais para o entendimento da natureza da combustão e a preparação para experimentos posteriores.
- Joseph Priestley (1774): É amplamente creditado com a descoberta do oxigênio. Em um experimento, ele isolou um gás, que ele denominou “ar deflogisticado”, que sustentava a combustão mais vigorosamente do que o ar comum. Apesar de não compreender completamente a natureza desse gás, Priestley reconheceu suas propriedades únicas.
- Antoine Lavoisier (1778): Lavoisier, através de experimentos rigorosos, demonstrou que o “ar deflogisticado” de Priestley era um componente fundamental do ar atmosférico. Ele cunhou o nome “oxigênio” e formulou a teoria da combustão correta, que explicava a importância do oxigênio nesse processo. Sua abordagem científica rigorosa e documentação detalhada foram cruciais para a aceitação da descoberta.
Impacto da Descoberta na Sociedade
A descoberta do oxigênio teve um impacto profundo na sociedade, indo muito além do campo da ciência. A compreensão do oxigênio foi crucial para a evolução da química, medicina, e tecnologia. A capacidade de produzir e controlar o oxigênio permitiu avanços notáveis em áreas como:
- Medicina: A aplicação de oxigênio em tratamentos médicos, como o auxílio à respiração em casos de asfixia ou insuficiência respiratória, revolucionou a prática médica.
- Indústria: A utilização do oxigênio em processos industriais, como a soldagem e a metalurgia, melhorou a eficiência e a produtividade.
- Entendimento da Vida: O papel do oxigênio na respiração celular e na manutenção da vida foi demonstrado, o que ampliou nossa compreensão dos processos biológicos.
Evolução das Técnicas de Isolamento
A descoberta do oxigênio foi acompanhada pelo desenvolvimento de técnicas mais eficazes para isolar e analisar substâncias químicas. Os métodos, inicialmente simples, evoluíram para técnicas mais sofisticadas, como a destilação fracionada, permitindo que os cientistas identificassem e caracterizassem diferentes componentes do ar.
Conceitos Relacionados
A compreensão do número atômico é fundamental para entender a estrutura dos átomos e a organização dos elementos na tabela periódica. Ele nos permite relacionar propriedades fundamentais, como a massa atômica, o número de elétrons e a posição do elemento na tabela. Neste contexto, exploraremos a relação entre o número atômico e outras propriedades atômicas, desvendando como essas informações se interconectam e são usadas para compreender o comportamento dos elementos.
Número Atômico x Massa Atômica
A relação entre o número atômico e a massa atômica é intrincada, pois o número atômico, que representa o número de prótons no núcleo, não determina completamente a massa do átomo. A massa atômica reflete a massa total de prótons, nêutrons e elétrons, sendo a contribuição dos elétrons insignificante em comparação com as partículas nucleares. A massa atômica de um elemento é a média ponderada das massas dos seus isótopos, considerando a abundância relativa de cada isótopo.
| Conceito | Explicação Detalhada | Exemplos | Relação com outros Conceitos |
|---|---|---|---|
| Número Atômico x Massa Atômica | O número atômico (Z) define o número de prótons no núcleo, enquanto a massa atômica (A) reflete a massa total do átomo, considerando a contribuição dos prótons e nêutrons. A massa atômica média de um elemento é influenciada pela existência de isótopos, que possuem o mesmo número de prótons mas diferentes números de nêutrons. | O hidrogênio (Z=1) tem três isótopos: prótio (1 próton, 0 nêutron), deutério (1 próton, 1 nêutron) e trítio (1 próton, 2 nêutrons). A massa atômica média do hidrogênio é afetada pela abundância relativa de cada isótopo. O carbono (Z=6) possui isótopos com diferentes massas atômicas, mas o mesmo número atômico. | A relação é direta, mas não linear, pois a massa atômica é afetada pelo número de nêutrons, que varia entre os isótopos. |
Número Atômico x Número de Elétrons
Em um átomo neutro, o número de elétrons é igual ao número de prótons. A carga positiva dos prótons é balanceada pela carga negativa dos elétrons, resultando em uma carga líquida nula. O número atômico define o número de prótons, determinando, consequentemente, o número de elétrons em um átomo neutro.
| Conceito | Explicação Detalhada | Exemplos | Relação com outros Conceitos |
|---|---|---|---|
| Número Atômico x Número de Elétrons | A igualdade entre o número de prótons e elétrons em um átomo neutro garante a neutralidade da carga elétrica. O número atômico define o número de prótons, o qual é igual ao número de elétrons em um átomo neutro. | O oxigênio (Z=8) tem 8 prótons e, portanto, 8 elétrons em um átomo neutro. O sódio (Z=11) tem 11 prótons e, consequentemente, 11 elétrons em um átomo neutro. | A neutralidade da carga é alcançada pela igualdade de cargas positivas e negativas. |
Importância do Número Atômico na Tabela Periódica
O número atômico é a base da organização da tabela periódica. Os elementos são dispostos em ordem crescente de número atômico, permitindo a visualização de tendências e padrões nas propriedades dos elementos. A tabela periódica demonstra como as propriedades dos elementos se repetem periodicamente, em função do número atômico.
| Conceito | Explicação Detalhada | Exemplos | Relação com outros Conceitos |
|---|---|---|---|
| Importância do Número Atômico na Tabela Periódica | O número atômico é a chave para a organização dos elementos na tabela periódica, pois determina a posição do elemento em ordem crescente. Esta organização reflete as propriedades periódicas dos elementos. | O hidrogênio (Z=1) é o primeiro elemento da tabela periódica. O oxigênio (Z=8) está no segundo período e no grupo 16. | A periodicidade das propriedades dos elementos é uma consequência direta da organização dos elementos em função do número atômico. |
Organização dos Elementos na Tabela Periódica
A tabela periódica é organizada em períodos (linhas horizontais) e grupos (colunas verticais). Os períodos refletem o preenchimento das camadas eletrônicas, enquanto os grupos agrupam elementos com propriedades químicas semelhantes. A organização da tabela periódica reflete as tendências e padrões das propriedades periódicas.
| Conceito | Explicação Detalhada | Exemplos | Relação com outros Conceitos |
|---|---|---|---|
| Organização dos Elementos na Tabela Periódica | A tabela periódica organiza os elementos em períodos e grupos. Os períodos refletem os níveis de energia dos elétrons, e os grupos, as similaridades nas propriedades químicas. | O grupo 1 (metais alcalinos) contém elementos como lítio, sódio e potássio, que compartilham propriedades químicas similares. O período 3 inclui elementos como sódio, magnésio e cloro, mostrando variações nas propriedades ao longo do período. | A organização reflete a periodicidade das propriedades dos elementos, como eletronegatividade, raio atômico, etc. |
Importância do Número Atômico na Química Moderna
O número atômico, um conceito fundamental na química, é a chave para entender a identidade e o comportamento dos elementos. Ele nos revela a quantidade de prótons no núcleo de um átomo, definindo sua posição na tabela periódica e, consequentemente, suas propriedades químicas. Compreender essa relação é essencial para prever e manipular reações químicas, desde processos industriais até a busca por novas drogas e materiais.O número atômico, como a identidade do elemento, é a base para a organização da tabela periódica.
Ele determina a estrutura eletrônica do átomo, influenciando suas tendências de ligação e reatividade. Essa informação permite prever as características químicas de um elemento, como sua capacidade de formar ligações iônicas, covalentes ou metálicas. A compreensão do número atômico é crucial para interpretar as propriedades químicas e físicas dos elementos e suas interações.
Previsão do Comportamento Químico
O número atômico, ao determinar o número de elétrons na camada de valência, impacta diretamente a reatividade do elemento. Elementos com o mesmo número de elétrons de valência tendem a exibir comportamentos químicos semelhantes. Por exemplo, os elementos do grupo 1 (metais alcalinos) possuem um elétron na camada de valência, o que os torna altamente reativos, formando facilmente íons positivos.
Essa previsibilidade, baseada no número atômico, é fundamental para a síntese de novos compostos e a otimização de processos químicos.
Utilização em Cálculos Químicos
O número atômico é fundamental em cálculos estequiométricos, que determinam as proporções em que as substâncias reagem. A equação química, por exemplo, indica as proporções de átomos envolvidos em uma reação, e o número atômico identifica esses átomos. Em síntese, o número atômico permite a previsão das quantidades de produtos formados e a identificação dos reagentes necessários.
Uso em Diferentes Áreas da Química
O número atômico é crucial em diversas áreas da química, como:
- Química Orgânica: Na identificação de átomos em moléculas orgânicas, permitindo a determinação de suas estruturas e a previsão de suas propriedades, como ponto de fusão, ponto de ebulição e reatividade. A compreensão das ligações entre átomos, impulsionada pelo número atômico, é fundamental para o entendimento da química orgânica.
- Química Inorgânica: O número atômico é fundamental para a classificação e a previsão do comportamento de elementos e compostos inorgânicos. A organização da tabela periódica, baseada no número atômico, permite prever as propriedades dos elementos e suas reações químicas.
- Química Analítica: Na identificação de elementos em amostras, utilizando técnicas espectroscópicas que dependem da estrutura eletrônica, influenciada pelo número atômico.
Comparação do Uso em Diferentes Ramos da Química
Apesar de fundamental em todos os ramos, o papel do número atômico varia ligeiramente. Em química orgânica, ele é mais usado para identificar átomos em moléculas complexas. Em química inorgânica, o número atômico é fundamental para prever propriedades de elementos isolados. Em química analítica, o número atômico auxilia na identificação dos componentes presentes na amostra. Apesar das nuances, o conceito do número atômico é um fio condutor unindo os diferentes ramos da química.
Aplicação em Reações Químicas
O número atômico influencia diretamente a formação de ligações químicas. A estrutura eletrônica do átomo, determinada pelo número atômico, define a capacidade de receber ou doar elétrons, o que afeta a natureza da ligação e, consequentemente, o comportamento químico.
O número atômico determina o número de elétrons na camada de valência, influenciando a reatividade e as ligações químicas.
Por exemplo, o número atômico do sódio (11) indica que ele possui um elétron na camada de valência, o que o torna altamente reativo. Essa informação é crucial para prever a reação do sódio com água, resultando em uma reação vigorosa.
Importância na Vida Diária

Source: com.br
O oxigênio, elemento essencial para a vida na Terra, desempenha um papel crucial em inúmeros processos, desde os mais ínfimos mecanismos celulares até as grandes indústrias. Compreender seu número atômico, 8, e suas propriedades permite-nos apreciar a sua fundamental importância na vida cotidiana.
Descrição Geral do Oxigênio
O número atômico do oxigênio, 8, indica que cada átomo de oxigênio possui 8 prótons em seu núcleo. Esta característica fundamental influencia as propriedades do elemento, como sua reatividade e comportamento em diferentes contextos. O oxigênio, na sua forma mais comum, é um gás incolor, inodoro e insípido, essencial para a respiração e a combustão. Sua forma diatômica, O₂, é um gás à temperatura ambiente.
O oxigênio possui um ponto de fusão extremamente baixo, tornando-o um gás na maior parte das condições encontradas na Terra. Sua reatividade é alta, caracterizada por sua facilidade de formar ligações químicas com outros elementos, principalmente através de reações de oxidação.
Importância na Vida Diária
A importância do oxigênio na vida diária é inegável. A respiração celular, processo fundamental para a vida de todos os seres vivos, depende diretamente da disponibilidade de oxigênio. A oxidação de alimentos para liberar energia, por exemplo, o metabolismo dos açúcares para gerar ATP, requer a presença do oxigênio. Em humanos, o oxigênio é essencial para o funcionamento de todos os órgãos e sistemas.
Além disso, a combustão, essencial em inúmeros processos, desde a queima de combustíveis fósseis até a utilização de fósforos, depende da reação com o oxigênio.
Efeitos da Ausência de Oxigênio
A ausência ou a deficiência de oxigênio podem ter consequências severas. Em seres vivos, a falta de oxigênio pode levar a asfixia e morte. Em processos industriais, a falta de oxigênio pode comprometer a eficiência e a segurança de processos como a produção de aço, a soldagem e a queima de combustíveis.
Compreensão do Número Atômico e Saúde
O número atômico do oxigênio influencia suas propriedades químicas e, consequentemente, seu impacto na saúde humana. O oxigênio, em concentrações apropriadas, é crucial para a respiração celular e a manutenção da vida. Entretanto, concentrações excessivas de radicais livres, derivados da reação do oxigênio com outros elementos, podem danificar as células e contribuir para o envelhecimento e doenças. A compreensão desses mecanismos é fundamental para o desenvolvimento de estratégias de prevenção e tratamento.
Usos do Oxigênio em Diferentes Contextos
O oxigênio é amplamente utilizado em diversos contextos, tanto na medicina quanto na indústria.
- Usos Médicos: A terapia com oxigênio é essencial em hospitais para pacientes com dificuldades respiratórias, auxiliando na manutenção dos níveis adequados de oxigênio no sangue. Em cirurgias, o oxigênio é usado para garantir um ambiente apropriado para a manutenção da vida dos pacientes.
- Usos Industriais: A produção de aço, a soldagem e a fabricação de diversos produtos químicos utilizam o oxigênio em processos de combustão e oxidação. A queima de combustíveis fósseis também requer o oxigênio como reagente.
- Usos Domésticos: Embora menos evidente, o oxigênio está presente em processos domésticos, como a queima de madeira em fogões e churrascos.
Organização da Informação em Tabela
| Contexto | Exemplo | Processo que depende do oxigênio | Implicações para a Saúde |
|---|---|---|---|
| Respiração | Humanos inspirando ar | Respiração celular | Manutenção da vida |
| Combustão | Queima de madeira | Combustão | Liberação de energia |
| Soldagem | Soldagem de metais | Reações de oxidação | Produção de metais |
| Terapia Respiratória | Uso de cilindros de oxigênio em hospitais | Suporte respiratório | Tratamento de doenças respiratórias |
Propriedades Físicas do Oxigênio: Qual Numero Atomico Do Oxigenio
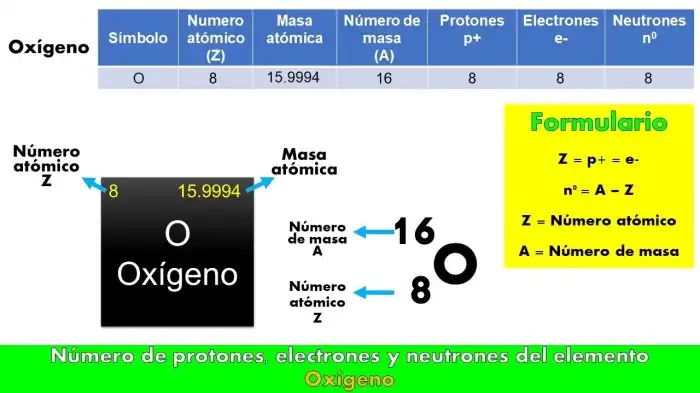
Source: escuelaparticulararrayan.cl
O oxigênio, elemento fundamental para a vida, apresenta propriedades físicas únicas que o diferenciam de outros elementos. Compreender essas propriedades é crucial para diversas aplicações, desde a respiração humana até a utilização em processos industriais. Seu número atômico, 8, influencia significativamente essas características. Vamos mergulhar neste fascinante mundo das propriedades físicas do oxigênio!O número atômico do oxigênio, 8, determina a estrutura eletrônica do átomo, o que, por sua vez, influencia suas interações com outros átomos e suas propriedades físicas, como estado físico, ponto de fusão e ponto de ebulição.
Essas propriedades são essenciais para compreender a função do oxigênio em diversas reações químicas e processos biológicos.
Estado Físico
O oxigênio, na temperatura ambiente, encontra-se no estado gasoso. Essa propriedade é determinada pelas fracas forças intermoleculares presentes entre as moléculas de oxigênio, permitindo que elas se movimentem livremente. Este estado gasoso é vital para sua função na respiração e em diversas aplicações industriais.
Ponto de Fusão
O ponto de fusão do oxigênio é extremamente baixo, em torno de -218,79 °C. Essa característica, relacionada à fraca interação entre as moléculas, contribui para o estado gasoso do oxigênio em condições normais. O baixo ponto de fusão, comparado a outros elementos, reflete a baixa energia necessária para que as moléculas se separem e passem do estado sólido para o líquido.
Ponto de Ebulição
O ponto de ebulição do oxigênio é ligeiramente mais elevado que o ponto de fusão, em torno de -182,96 °C. Essa diferença reflete a maior energia necessária para que as moléculas se separem e passem do estado líquido para o gasoso. A comparação com outros elementos revela a influência das forças intermoleculares na mudança de fase. Por exemplo, o nitrogênio, que tem um ponto de ebulição ligeiramente mais baixo, também é um gás à temperatura ambiente.
Densidade
A densidade do oxigênio é menor que a da água, o que explica por que o oxigênio, no estado gasoso, é mais leve e tende a flutuar. Essa propriedade tem implicações importantes em processos de separação e purificação.
Tabela de Propriedades Físicas
| Propriedade | Valor | Unidade | Observações |
|---|---|---|---|
| Estado Físico | Gasoso | – | À temperatura ambiente |
| Ponto de Fusão | -218,79 | °C | Baixo, devido às fracas forças intermoleculares |
| Ponto de Ebulição | -182,96 | °C | Ligeiramente superior ao ponto de fusão |
| Densidade (a 0 °C) | 1,429 | g/L | Menor que a da água |
Importância das Propriedades Físicas
As propriedades físicas do oxigênio são fundamentais em diversas áreas, incluindo a medicina, a indústria e a ciência. A baixa densidade do oxigênio, por exemplo, permite seu uso em equipamentos de respiração e em processos de combustão. O baixo ponto de ebulição é essencial para a liquefação e separação do oxigênio em escala industrial. Compreender essas propriedades é essencial para o desenvolvimento de tecnologias e processos que envolvem o oxigênio.
Exemplos de Reações Químicas Envolvendo Oxigênio
Source: com.br
O oxigênio, elemento vital para a maioria das formas de vida na Terra, participa de inúmeras reações químicas. Sua reatividade, influenciada por seu número atômico 8 e pela estrutura de seus átomos, é fundamental para compreendermos processos desde a respiração até a combustão. Neste tópico, exploraremos exemplos concretos dessas reações, destacando a importância do número atômico na determinação do comportamento químico do elemento.
Reações de Combustão
As reações de combustão são reações químicas rápidas que liberam calor e luz, frequentemente envolvendo oxigênio como um dos reagentes. O número atômico do oxigênio, 8, determina a sua capacidade de formar ligações químicas e, consequentemente, a sua participação nesses processos. A intensidade da combustão depende da quantidade de oxigênio disponível e das propriedades dos outros reagentes.
| Reagentes | Produtos | Condições | Número Atômico |
|---|---|---|---|
| Metano (CH4) + Oxigênio (O2) | Dióxido de Carbono (CO2) + Água (H2O) | Presença de faísca ou fonte de calor | 8 |
| Propano (C3H8) + Oxigênio (O2) | Dióxido de Carbono (CO2) + Água (H2O) | Presença de faísca ou fonte de calor | 8 |
| Álcool etílico (C2H5OH) + Oxigênio (O2) | Dióxido de Carbono (CO2) + Água (H2O) | Presença de faísca ou fonte de calor | 8 |
A combustão completa do metano, por exemplo, ocorre quando há um suprimento adequado de oxigênio, resultando em dióxido de carbono e água como únicos produtos. Em condições de baixa disponibilidade de oxigênio, a combustão incompleta pode produzir monóxido de carbono (CO), um gás tóxico.
Reações de Oxidação
A oxidação é um processo químico onde um elemento perde elétrons. O oxigênio, com seu alto potencial de oxidação, é um agente oxidante comum. A reatividade do oxigênio nesses processos depende da energia de ativação necessária para iniciar a reação.
| Reagentes | Produtos | Condições | Número Atômico |
|---|---|---|---|
| Ferro (Fe) + Oxigênio (O2) | Óxido de Ferro (Fe2O3) | Temperatura ambiente | 8 |
| Magnésio (Mg) + Oxigênio (O2) | Óxido de Magnésio (MgO) | Temperatura elevada | 8 |
O número atômico do oxigênio impacta a força de atração dos seus elétrons, permitindo que ele forme ligações com outros elementos. A formação de óxidos, como o óxido de ferro, é um exemplo comum. A velocidade da reação de oxidação depende da temperatura e da área de superfície dos reagentes.
Comparação de Reações
A reatividade do oxigênio varia significativamente em diferentes condições. Em temperaturas mais altas, as reações tendem a ocorrer mais rapidamente, devido ao aumento da energia cinética das moléculas. A presença de catalisadores também pode acelerar ou desacelerar o processo. A concentração de oxigênio é crucial para a taxa de reação.
Imagens Ilustrativas
As imagens ilustrativas são ferramentas cruciais para a compreensão visual do oxigênio e sua relação com a tabela periódica, a estrutura atômica e os processos químicos. Elas tornam os conceitos abstratos mais acessíveis, permitindo uma assimilação mais profunda do tema.
Tabela Periódica
A tabela periódica é uma organização sistemática dos elementos químicos, onde o oxigênio ocupa uma posição específica que reflete suas propriedades. A posição do elemento na tabela periódica revela informações valiosas sobre suas características químicas e físicas. Esta imagem demonstra a localização do oxigênio (O), com seu número atômico (8) destacado, em meio aos demais elementos.

Legenda: A imagem apresenta a Tabela Periódica completa, destacando a posição do oxigênio no grupo 16 (calcogênios) e no período 2. A cor específica do oxigênio e o destaque do seu número atômico (8) facilitam a identificação. A localização do oxigênio na tabela indica suas propriedades químicas, como sua tendência a formar ligações covalentes e sua alta reatividade.
A classificação em grupos e períodos organiza os elementos com base em suas similaridades e diferenças em suas propriedades atômicas e químicas.
Estrutura Atômica do Oxigênio
A compreensão da estrutura atômica do oxigênio é fundamental para entender suas propriedades químicas. Esta representação visual demonstra os componentes subatômicos do átomo de oxigênio, com destaque para o número atômico (8) e o número de elétrons na camada de valência.

Legenda: A imagem ilustra o núcleo do átomo de oxigênio com 8 prótons e 8 nêutrons. Os 8 elétrons orbitam o núcleo em diferentes níveis de energia (camadas eletrônicas). A camada de valência, a mais externa, possui 6 elétrons, o que explica a capacidade do oxigênio de formar duas ligações covalentes em muitas de suas reações químicas. A relação entre o número atômico e a estrutura atômica é clara: o número atômico (8) define o número de prótons, que, por sua vez, determina o número de elétrons no átomo neutro.
Os níveis de energia e orbitais são representados para demonstrar a organização dos elétrons ao redor do núcleo.
Processo Químico com Oxigênio, Qual Numero Atomico Do Oxigenio
A combustão é um exemplo clássico de reação química que envolve o oxigênio. A imagem a seguir demonstra a combustão completa do metano (CH 4), um composto orgânico.

Legenda: A imagem mostra a equação química balanceada para a combustão completa do metano: CH 4 + 2O 2 → CO 2 + 2H 2O. Os reagentes (metano e oxigênio) são representados em uma cor e os produtos (dióxido de carbono e água) em outra. O oxigênio, como oxidante, é essencial para a reação de combustão, que libera energia na forma de calor e luz.
O número atômico do oxigênio (8) influencia a formação de ligações covalentes no dióxido de carbono e na água, produtos da reação.
Experimento para Determinar o Número Atômico do Oxigênio
O número atômico do oxigênio pode ser determinado através de métodos espectroscópicos, que analisam a interação da luz com a matéria. Este experimento hipotético demonstra uma técnica para a determinação do número atômico do oxigênio.

Legenda: A imagem demonstra um experimento hipotético onde a análise espectral da luz emitida ou absorvida pelo oxigênio é usada para determinar seu número atômico. A análise espectral revela os espectros característicos do oxigênio, que correspondem a transições eletrônicas entre os diferentes níveis de energia dos átomos de oxigênio. O espectro é analisado para identificar os comprimentos de onda da luz absorvida ou emitida, que fornecem informações sobre as energias dos níveis eletrônicos do oxigênio e, consequentemente, seu número atômico.
Importância do Oxigênio para a Vida na Terra
O oxigênio é fundamental para a vida na Terra. A imagem a seguir ilustra a importância do oxigênio para a respiração celular e a sobrevivência de diversos organismos.

Legenda: A imagem mostra a respiração celular em nível microscópico, onde o oxigênio é usado para liberar energia das moléculas de alimento. A imagem também pode incluir organismos dependentes do oxigênio, como animais e plantas, ou a importância do oxigênio na atmosfera para a sobrevivência de várias espécies. O ciclo da vida está intrinsecamente ligado à presença do oxigênio na Terra.
Em suma, o número atômico 8 do oxigênio, apesar de aparentemente simples, desvenda um universo de propriedades e aplicações. Desde sua presença vital para a vida na Terra até sua utilização em processos industriais, o oxigênio demonstra sua importância em inúmeros contextos. Ao longo desta jornada, exploramos a história, as propriedades, as reações e as aplicações deste elemento essencial, revelando sua presença crucial em nosso cotidiano.
Qual a diferença entre isótopos de oxigênio e como isso afeta o número atômico?
Os isótopos do oxigênio, como o oxigênio-16, oxigênio-17 e oxigênio-18, diferem no número de nêutrons em seus núcleos. Apesar dessas diferenças, o número atômico, que representa o número de prótons, permanece inalterado em todos eles, sendo 8 para todos os isótopos de oxigênio. Portanto, a identidade do elemento, neste caso o oxigênio, não é afetada pela variação no número de nêutrons.
Como o oxigênio é utilizado na medicina?
Na medicina, o oxigênio é essencial para o tratamento de diversas doenças respiratórias e em situações de emergência. É utilizado em terapia respiratória, suporte vital e em procedimentos cirúrgicos, garantindo o fornecimento adequado de oxigênio aos pacientes. Em situações críticas, como parada cardíaca, o oxigênio é fundamental para a reanimação.
Qual a importância do oxigênio para a combustão?
O oxigênio é um reagente essencial na maioria das reações de combustão. Ele reage com outros materiais, como combustíveis, para liberar energia na forma de calor e luz. A combustão completa de um combustível orgânico, como o metano, por exemplo, requer oxigênio e resulta na formação de dióxido de carbono e água.












